您当前的位置:检测资讯 > 检测案例
嘉峪检测网 2019-03-04 22:47
动态心电图系统注册案例分享
01
产品概述
1)产品名称:动态心电记录仪、动态心电图机、动态心电图系统、Holter
2)结构组成:主机、心电电极
3)工作原理:动态记录仪通过放置在患者体表的心电电极,获取患者心脏活动电位,记录各测量点间电位差得到心电图信号。动态心电分析软件将相关心电数据信息进行回放、分析、分类和统计。
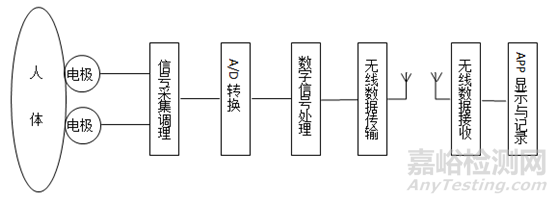
4)作用机理:心脏在机械收缩之前,首先产生电激动,心肌激动所产生的微小电流可经过身体组织传导到体表,使体表不同部位产生不同的电位,对这种心脏动作电位的可见记录就是心电图。
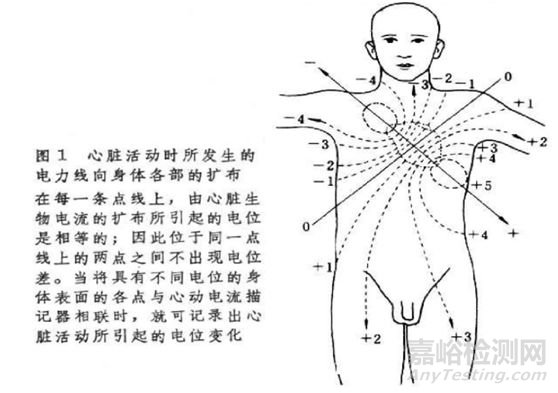
5)导联:不同电极间的电位差;有双极肢体导联、加压导联、单极胸导联等;
通道:单通道(仅能显示单导联结果)和多通道(能显示多导联结果);
6)典型结构:

02
分类信息
|
一级 |
二级 |
三级 |
产品描述 |
预期用途 |
品名举例 |
管理类别 |
|
07 医用诊察和监护器械 |
03生理参数分析测量设备 |
01心电测量、分析设备 |
通常由主机、供电电源、心电电缆、心电电极、记录读取设备和动态心电分析软件组成。主机部分通常包括信号输入部分,放大回路、控制电路、记录部分。通过电极将体表不同部位的电信号检测出来,经过滤波、放大、模数转化形成心电波形并进行连续记录和分析。 |
用于测量、采集、观察和存储动态心电图,供临床诊断。 |
动态心电图机 |
Ⅱ |
03
注册单元
可能情况:
1)全套产品可放在一个注册单元;
2)采集端和后续数据处理软件可分为两个注册单元;
3)心电电极和主机可分为两个注册单元;
4)如心电电极采用胶贴粘结的方式固定在人体皮肤上,胶贴为一次性无源耗材,不可划分在一个注册单元。
5)如产品具有不同型号,如其工作原理、性能结构基本相同,可考虑放在一个注册单元。
04
临床信息
1)不需要动物试验或小样本试验
2)免临床目录
|
07-03-01 |
动态心电记录仪 |
动态心电记录仪通常由移动式记录器和导联线组成,也可包括数据管理软件和附件(导联线、充电器、USB线等),可按导联数、技术参数、预期用途、附加辅助功能等不同分为若干型号;供人体24小时动态心电监测用。不包括自动分析诊断功能。产品性能指标采用下列参考标准中的适用部分,如:YY 0885-2013 医用电气设备 第2部分:动态心电图系统安全和基本性能专用要求。 |
3)如具有自动分析诊断功能,需要进行临床试验。
05
技术要求
产品需满足24h的连续测量、如涉及分析,需要使用动态心电图数据库进行分析;
其余指标:标准灵敏度、定标电压、灵敏度控制等……
具体见:
|
YY 0885—2013 |
动态心电图系统安全和基本性能专用要求 |
06
主要参考技术标准或规范
表1相关产品标准
|
标准编号 |
标准名称 |
|
GB 9706.1—2007 |
医用电气设备 第1部分:安全通用要求 |
|
GB/T 191—2008 |
包装储运图示标志 |
|
GB/T 14710—2009 |
医用电器环境要求及试验方法 |
|
GB/T 16886.1—2011 |
医疗器械生物学评价 第1部分:评价与试验 |
|
GB/T 16886.5—2017 |
医疗器械生物学评价 第5部分:体外细胞毒性试验 |
|
GB/T 16886.10—2017 |
医疗器械生物学评价 第10部分:刺激与迟发性超敏反应试验 |
|
GB/T 16886.12—2005 |
医疗器械生物学评价 第12部分:样品制备与参照样品 |
|
GB/T 25000.51—2016 |
软件工程 软件产品质量要求和评价(SQuaRE)商业现货(COTS)软件产品的质量要求和测试细则 |
|
YY/T 0316—2016 |
医疗器械 风险管理对医疗器械的应用 |
|
YY 0505—2012 |
医用电气设备 第1-2部分:安全通用标准 并列标准:电磁兼容要求和试验 |
|
YY 0885—2013 |
动态心电图系统安全和基本性能专用要求 |
|
YY/T 0466.1—2009 |
医疗器械 用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求 |
|
YY/T 0664—2008 |
医疗器械软件 软件生存周期过程 |
|
YY/T 0708—2009 |
医用电器设备 第1-4部分:安全通用要求并列标准:可编程医用电气系统 |
|
YY/T 1474—2016 |
医疗器械可用性工程对医疗器械的应用 |
|
动态心电图系统注册技术审查指导原则 |
|
07
检测机构
检验所
08
其它需要关注的内容
1)在一个心电仪上集成心电图机、动态心电、心电监护等多功能;
2)在一个测量仪或监护仪上集成心电、体温、血氧等多功能;
3)向便携式、可穿戴式转化,以安装在移动平台上的软件替代原主机功能;
将产品拆分为独立的心电记录仪和心电数据分析系统,通过心电记录仪和数据处理软件独立申报,分别可免临床。

来源:AnyTesting


