您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-04-03 16:24
在化学药品分析方法开发工作中可以参考本文的一些内容。
一、序
文章的版块架构借鉴了《化学药物质量控制分析方法验证技术指导原则》的内容,甚至很多文字表述都抄袭了其中一些语句,在此向《化学药物质量控制分析方法验证技术指导原则》课题研究组的老师们致敬,恳请原谅。
二、概述
保证药品安全、有效、质量可控是药品研发和评价应遵循的基本原则,其中,对药品进行质量控制是保证药品安全有效的基础和前提。为达到控制质量的目的,需要多角度、多层面来控制药品质量,也就是说要对药物进行多个项目测试,来全面考察药品质量。
在建立质量标准时,如无可以参考的法定标准,就需要开发分析方法。如果药品生产工艺变更、制剂组分变更,质量标准分析方法也需要进行再开发。为使测试结果准确、可靠,必须对所开发的分析方法的科学性、准确性和可行性进行评估,以充分表明分析方法符合测试项目的目的和要求。
方法开发的目的是建立一个科学、合理的分析方法,能有效控制药品的内在质量。从实质上讲,方法开发就是根据检测项目的要求,结合物料本身的性质、相关研究数据、指导原则、理论等,提出某种假设,经过试验研究该假设是否成立,以此确定方法的各项参数,以风险管理对方法的各项参数进行系统的研究与评估,通过设计合理的试验确认所采用的分析方法能否符合检测项目的要求,并制定合理的可接受标准。
分析方法开发过程需要进行适当的验证,对高风险因素进行评估,证明所选择参数的合理性,保障后期完整的正式方法验证能顺利完成。某些情况下,正式方法验证完成后,才能确定分析方法的某些参数。
因此方法开发与验证是一个互相渗透不可分割的整体,都是属于完整的方法研究的一部分,二者之间并无明显的界限。如果方法验证失败,则需要重新进行方法开发,只有方法验证完成,分析方法才最终确定。从这个意义上来说,方法验证其实是方法开发的一部分。
本指导原则主要包括方法开发的一般原则、方法开发的具体内容、方法再开发与对方法开发的评价等内容。
本指导原则主要适用于化学药品,化工产品、生物制品与中药可以参考相关内容。
三、方法开发的一般原则
1、统筹原则
启动方法开发的实验之前,应当充分研究物料性质,查阅相关文献资料;应当在早期调查相关实验室的设备与人员水平,建立的分析方法需与之相适应,必要时在方法开发过程中进行相应的实验研究,减少分析方法在不同实验室转移的风险。
2、兼顾原则
分析方法采用的技术与设备应当在通用性与先进性二者之间进行权衡,一般情况下应当采用通用的技术与设备确保分析方法的在其他实验室的良好重现,在可获得的情况下为了提高工作效率或质量可以采用先进的技术与设备。
3、证成原则
方法开发过程也是一个抉择证成的过程,每一个与分析方法相关的决定均需要用理论说明或者数据证明该决定的合理性。
4、稳健原则
建立的方法应该有一定的稳健性,不同实验室、不同型号品牌的仪器设备、不同人员、一定范围内实验参数的变化等条件的变动应能输出一致的结果。一般情况下,应避免分析方法必须严格限制某些参数才能达成符合预期结果的情况。
四、方法开发的具体内容
方法开发主要包括物料处理、实验参数、系统适用性试验、计算方法、可接受标准等五个方面的选择过程。由于分析方法具有各自的特点,并随分析对象而变化,因此需要根据具体方法拟订需要研究的内容。下表列出分析项目与相应的研究内容可供参考。
表1 检验项目和研究内容
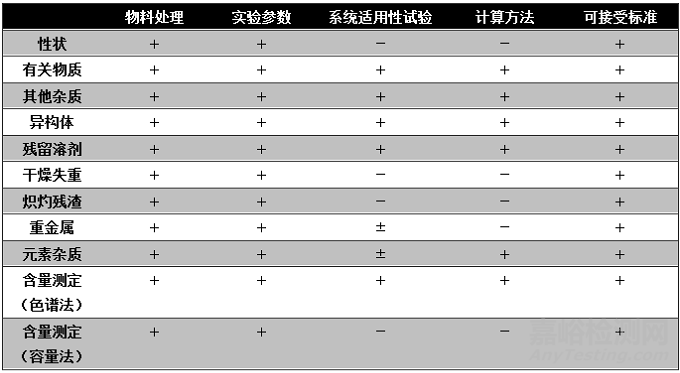
注:“+”为应当研究,“-”为不用研究,“±”为视情况决定。
1、物料处理
物料处理是指供试品、对照品等检测过程中涉及的物料的处理方式的研究,包括稀释剂、物料用量、供试品浓度、对照品浓度、操作方法等参数的选择。
方法开发过程中应当对检测过程中的物料处理方式进行系统的研究与评估,对物料处理的各个参数作出科学合理的选择。
1.1 稀释剂
分析方法中的稀释剂是指当其与物料混合时,能够改变物料形态,使之满足相关检测的要求。稀释剂可以是溶剂、溶液、固体粉末等。
稀释剂应当能与相关物料良好混合,例如液体稀释剂与物料形成溶液,应当具有一定的溶解性;稀释剂应当在分析方法中具有惰性,或对分析结果的影响较小,可以用空白试验消除;物料在稀释剂中应当在一定合理的时间内稳定。
1.2 物料用量
药品检测是以样本的检测结果评估总体的特定属性,需要对所取的样本是否能够代表总体的风险进行评估,因此应当对物料的取样方式和用量进行研究,说明或者证明在特定检测项下所取样本能够代表总体。
1.3 供试品、对照品浓度
检测结果需要有较为明显的响应足以让分析人员作出判断,因此供试品、对照品应当由适宜的浓度,在检测过程中产生适当的响应。在制定供试品、对照品浓度时应当根据可接受标准、仪器设备、系统适用性试验、计算方法等相关内容的约束综合考虑。例如有关物质的供试品浓度研究过程中,除了使方法的灵敏度、各组分的分离度等符合要求外,还需要满足计算方法的要求;如为面积归一化法则需要证明供试品浓度的响应者在线性范围内。
1.4 操作方法
对于物流处理的操作方法,需要评估对检测结果产生的风险。例如溶解操作溶液均一性对检测结果的影响;分层萃取对准确度的影响等。
2、实验参数
各项实验参数的选择应当进行必要的研究,科学合理的说明抉择过程。可以使用风险管理的方式进行相应研究,详细研究高风险参数,制定相应的应对策略。
以液相色谱法为例,流动相、色谱柱、进样体积、流速、洗脱程序、柱温、波长等参数的选择应当根据理论、经验等进行风险评估与应对,必要时以试验数据证明应对策略的合理性。如波长对检测结果的风险非常高,合理的波长选择能够降低该风险,波长选择的风险是否可接受,可以用线性、重复性等研究数据进行确认。
3、系统适用性试验
分析方法的整个系统中包含的样品、设备等内容可能与方法开发验证期间有差异,而这种差异在进行系统适用性研究期间确认为高风险因素,可能会造成检测结果的严重偏离,则应当制定相应的试验以区分该差异。
4、计算方法
分析方法中的计算方法需要与物料处理、实验参数等其他内容相适应,必要时用实验数据确认拟订的计算方法是否适用。例如面积归一化法计算有关物质的结果,供试品浓度的响应值应在线性范围内;如拟采用加校正因子的自身对照法计算有关物质的结果,需证明各已知杂质的校正因子均在适当的范围内。
5、可接受标准
药品相关检测项目的可接受标准主要从安全、质量可控两个角度考虑。
与安全相关检测项目的可接受标准,如有关物质、残留溶剂、元素杂质、基因毒性杂质、微生物限度等,新药应当从动物试验与临床试验的相关安全数据或参考相关指导原则说明制定限度的合理性;仿制药应当通过与参比制剂的质量对比或参考相关指导原则确认相关限度的合理性,如杂质水平低于或与参比制剂相当。
其他检测项目的可接受标准如水分、熔点、比旋度、含量测定等,应当根据实际可能达到的质量水平制定合理的限度。
五、方法再开发
在某些情况下,如原料药合成工艺改变、制剂处方改变、获得新的杂质对照品等,均有必要对分析方法进行再开发,以确认之前制订的分析方法的各项参数依然符合检测的需要。
事实上,药物研发中上述情况较为常见,分析方法再开发是一个反复和持续的过程。如在原料药工艺研究过程中,合成工艺反复调整,如果每次调整都需要开发新的分析方法并不现实,因此方法再开发是对发生改变的内容进行风险评估,根据风险的大小进行相应的研究。如获得新的杂质对照品的有关物质分析方法再开发,只需按照既定的方法检测,确认与其他组分达成良好分离、响应值在适当的范围即可。
六、对方法开发的评价
对于方法开发,有以下几个方面需要关注。
1、有关方法开发的一般考虑
方法开发的过程中应当充分评估各种潜在的风险,将风险的应当前移至方法开发阶段,减少后期出现问题的可能性。如为减少或避免方法转移失败的风险,在方法开发实施过程中,就应当评估方法转入实验室的人员、设备等情况,综合制定相应研究策略。如有关物质方法开发早期缺少杂质对照品,为减少色谱条件不相适应的风险,应在早期详细评估与预测可能存在的杂质类型与性质,并为此留出适当的储备等。
方法开发过程需要与其他研究部门良好互动,如原料药工艺发生改变,有关物质分析方法的再开发应当根据合成人员对工艺变化对应的杂质谱变化的评估结果进行相应的研究,如认为杂质谱发生变化的风险非常小,则无需调整有关物质分析方法。
负责方法开发的分析人员需要具有较为广泛的基础相关理论知识,能够根据样品性质、检测的目的等初步选择合理的检测方法,在各种内容的研究过程中能够根据理论知识选择合理的研究方向,避免产生一些理论中已经排除的错误。如分析人员了解液相色谱中的溶剂效应的概念,就能在稀释剂选择的过程中避免因稀释剂选择不当而导致异常的检测结果。
2、方法开发的整体性与系统性
方法开发的物料处理、实验参数、系统适用性试验、计算方法、可接受标准等五个方面内容之间相互关联,是一个整体,因此在方法开发过程中,应当每个参数的选择过程应整体地进行评价其合理性。如某基因毒性杂质可接受标准为ppm级,有可能就约束了实验参数中检测仪器的选择,可能只能选择质谱检测器;限度决定供试品浓度可能非常高,又约束了计算方法,如不能选择面积归一化法等;高供试品浓度也对稀释剂的选择提出了要求。
方法开发的检测项目之间也存在较多的关联,可以相互补充。如有关物质方法开发过程中发现某个特定杂质性质与其他组分相差极大,难以在一个条件下将其与其他组分完成分析检测,可以单独再建立一个分析方法检测该特定杂质。
3、方法开发的复杂性
方法开发过程中,实际情况较为复杂,应当具体情况具体分析,不提倡教条地应用本指导原则。此外,越来越多的新技术与新设备不断被应用于质量控制中,对于这些新技术与新设备如何应用于分析方法的开发应当根据实际情况进行判断,不能照搬本指导原则。
参考文献
《化学药物质量控制分析方法验证技术指导原则》
《ICHQ2》

来源:药事纵横


