您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-05-06 17:33
国家药典委员会关于《中国药典》2020年版四部通则增修订内容(第十批)的公示
《中国药典》2020年版四部通则修订草案第一、第二征求意见稿已于2018年2月起分批次社会各界公开征求意见。现形成了第三次征求意见稿(第十批)。为进一步完善药典通则内容,现公开征求意见,公示期一个月。
附件包括:1101无菌检查法、9206无菌检查用隔离系统验证指导原则、灭菌用生物指示剂指导原则,及生物指示剂耐受性检查法指导原则的第三次征求意见稿
法规链接:http://www.chp.org.cn/view/ff80808169148bfc0169e21a09617fcd?a=BZFL
海关总署 国家药品监督管理局关于《进口药品通关单》等3种监管证件扩大实施联网核查的公告(2019年第56号)
为进一步优化口岸营商环境,促进跨境贸易便利化,海关总署、国家药品监督管理局决定在前期联网核查试点基础上,对《进口药品通关单》等3种监管证件全面实施电子数据联网核查。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/336012.html
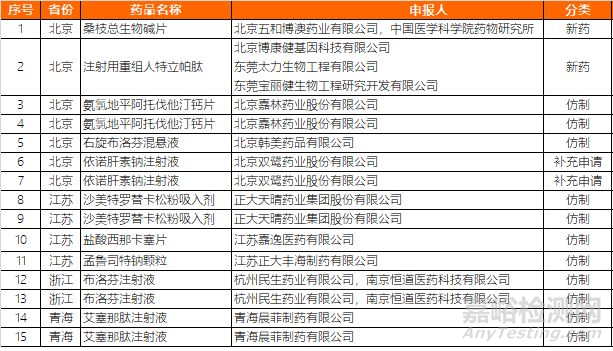
关于药物临床试验数据自查核查注册申请情况的公告(2019年第21号)
国家药品监督管理局决定对新收到的15个已完成临床试验申报生产的药品注册申请(见附件)进行临床试验数据核查。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/336056.html
关于注销铁蛋白放射免疫分析试剂盒等85个药品批准文号的公告(2019年第29号)
根据《中华人民共和国药品管理法实施条例》和《药品注册管理办法》的有关规定,国家药品监督管理局决定注销铁蛋白放射免疫分析试剂盒等85个药品批准文号。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/336059.html
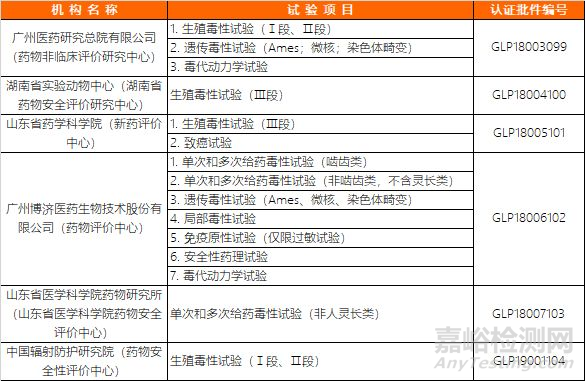
关于药物非临床研究质量管理规范认证公告(第2号)(2019年第30号)
国家药品监督管理局组织有关专家对广州医药研究总院有限公司(药物非临床评价研究中心)等6家机构进行了检查。经审核,该6家机构的生殖毒性试验(Ⅰ段、Ⅱ段)等试验项目符合药物GLP要求。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/336120.html
关于发布《药物临床试验期间安全性数据快速报告常见问答(1.0版)》的通知
2018年4月27日药品审评中心发布了《药物临床试验期间安全性数据快速报告的标准和程序》。该《标准和程序》实施以来,药审中心通过各种途径收到了一些反馈问题。针对存在的共性问题,药品审评中心组织起草了《药物临床试验期间安全性数据快速报告常见问答(1.0版)》,对于其中部分共性问题进行了统一解释和澄清,供申请人/ CRO公司参考和遵循,以进一步完善我国药物临床试验期间安全性数据快速报告相关工作。
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314843
关于公开征求ICH指导原则《M10:生物样品分析方法验证》意见的通知
ICH指导原则《M10:生物样品分析方法验证》现进入第3阶段征求意见。按照ICH相关章程要求,ICH的监管机构成员需收集本地区关于第2b阶段指导原则草案的意见并反馈ICH。
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314844
国家药典委员会关于乙醇国家药用辅料标准修订草案的公示(第二次)
国家药典委员会拟修订乙醇国家药用辅料标准,为确保标准的科学性、合理性和适用性,现第二次公示征求社会各界意见。公示期为一个月。
法规链接:http://www.chp.org.cn/view/ff80808169148bfc016a1003b68a5eba?a=BZFULIAO
国家药典委员会关于无水乙醇、单双硬脂酸甘油酯2个国家药用辅料标准草案的公示
我委拟制定无水乙醇、单双硬脂酸甘油酯2个国家药用辅料标准,为确保标准的科学性、合理性和适用性,现公示征求社会各界意见(详见附件)。公示期为三个月。
法规链接:http://www.chp.org.cn/view/ff80808169148bfc016a10068dfb5ec3?a=BZFULIAO
国家药典委员会关于《中国药典》2020年版四部通则增修订内容(第九批)的公示
《中国药典》2020年版四部通则修订草案已于2018年2月起分批次向社会各界公开征求意见。现形成了第二次征求意见稿(第九批)。为进一步完善药典通则内容,现公开征求意见,公示期一个月。
附件包括:1105微生物计数法、1121 抑菌效力检查法、1143 细菌内毒素检查法、1213 硫酸鱼精蛋白效价测定法,及9203药品微生物实验室质量管理指导原则的第二次征求意见稿
法规链接:http://www.chp.org.cn/view/ff80808169148bfc0169e21a09617fcd?a=BZFL
审核查验中心:公开征求仿制药一致性评价现场检查-企业指南(草案)意见
国家药品监督管理局食品药品审核查验中心组织起草了《企业指南:质量和疗效一致性评价仿制药品药学研制现场检查要求》和《企业指南:质量和疗效一致性评价仿制药品生产现场检查要求,现向社会公开征求意见。
法规链接:https://mp.weixin.qq.com/s/9pOPC0f3vhTpVKCe3q--LQ
国家药监局综合司再次公开征求《关于进一步完善药品关联审评审批和监管工作有关事宜的公告(征求意见稿)》意见
为了进一步完善药品与药用原辅料和包装材料关联审批,结合我国产业发展情况以及原辅包管理的历史沿革,国家药品监督管理局起草了《关于进一步完善药品关联审评审批和监管工作有关事宜的公告(征求意见稿)》并再次公开征求意见。
法规链接:http://www.nmpa.gov.cn/WS04/CL2101/336058.html?from=groupmessage&isappinstalled=0
国家药典委员会关于征求L-酒石酸等11个药用辅料标准收载入《中国药典》意见的函
按照《中国药典》编制规划,国家药典委员会组织有关单位制修订了部分药用辅料标准,有11个药用辅料标准草案经公示后未收到反馈意见,拟收载入下一版《中国药典》。
包括:L-酒石酸、丁基羟基茴香醚、伽马环糊精、果胶、间苯二酚、聚克立林钾、松香、椰子油、依地酸钙钠、月桂醇、棕榈酸
法规链接:http://www.chp.org.cn/view/ff80808169148bfc0169d6e892136998?a=BZFULIAO&from=timeline
药品管理法(修订草案)正式公布
4月26日,中国人大网发布药品管理法(修订草案)征求意见,向全社会征求意见,此后交付三审,三审后进一步表决,如果表决通过,新的药品管理法将正式出台。
法规链接:https://news.yaozh.com/archive/26125.html
国家药监局关于发布《M4:人用药物注册申请通用技术文档(CTD)》模块一文件及CTD中文版的通告(2019年第17号)
依据原食品药品监管总局《关于适用国际人用药品注册技术协调会二级指导原则的公告》(2018年第10号)有关规定,国家药品监督管理局组织制定了《M4:人用药物注册申请通用技术文档》模块一文件:行政文件和药品信息,现予以发布。自2019年7月1日起,对2018年第10号公告规定情形的药品注册申请,申请人应按照M4模块一文件要求提交资料。
同时,国家药品监督管理局组织翻译了M4指导原则全文,形成了中文版,一并予以发布。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/336252.html
国家药监局关于发布《药品信息化追溯体系建设导则》《药品追溯码编码要求》两项信息化标准的公告(2019年第32号)
为推动药品信息化追溯体系建设,国家药监局组织编制了《药品信息化追溯体系建设导则》和《药品追溯码编码要求》两项信息化标准。现予发布,自发布之日起实施。
法规链接:http://www.nmpa.gov.cn/WS04/CL2138/336781.html
关于聚葡萄糖国家药用辅料标准草案的公示
国家药典委员会拟制定聚葡萄糖国家药用辅料标准,为确保标准的科学性、合理性和适用性,现公示征求社会各界意见。公示期为三个月。
法规链接:http://www.chp.org.cn/view/ff80808169148bfc016a4dec4244660a?a=BZFULIAO
关于倍他环糊精、乳糖2个国家药用辅料标准修订草案的公示
国家药典委员会拟修订倍他环糊精、乳糖2个国家药用辅料标准,为确保标准的科学性、合理性和适用性,现公示征求社会各界意见。公示期为三个月。
法规链接:http://www.chp.org.cn/view/ff80808169148bfc016a4df150d86610?a=BZFULIAO
关于十二烷基硫酸钠国家药用辅料标准修订草案的公示(第二次)
国家药典委员会拟修订十二烷基硫酸钠国家药用辅料标准,为确保标准的科学性、合理性和适用性,现第二次公示征求社会各界意见。公示期为一个月。
法规链接:http://www.chp.org.cn/view/ff80808169148bfc016a4df6d63f6614?a=BZFULIAO
关于磷酸二氢钾、磷酸氢二钾、磷酸氢二钾三水合物3个国家药用辅料标准修订草案的公示
国家药典委员会拟修订磷酸二氢钾、磷酸氢二钾、磷酸氢二钾三水合物3个国家药用辅料标准,为确保标准的科学性、合理性和适用性,现公示征求社会各界意见。公示期为三个月。
法规链接:http://www.chp.org.cn/view/ff80808169148bfc016a572ab8067497?a=BZFULIAO
关于6个中药临床研究技术指导原则上网征求意见的通知
为深化药品审评审批制度改革,进一步鼓励中药创新,加快建立符合中药特点的技术评价标准体系,药审中心自2016年起滚动启动了42个指导原则的制修订工作。目前,《中药新药用于慢性便秘临床研究技术指导原则》、《中药新药用于小儿便秘临床研究技术指导原则》、《中药新药用于糖尿病足病临床研究技术指导原则》、《中药新药用于糖尿病肾脏疾病临床研究技术指导原则》、《中药新药用于糖尿病视网膜病变临床研究技术指导原则》、《中药新药用于糖尿病周围神经病变临床研究技术指导原则》等六项指导原则已完成起草工作,现上网公开征求意见,欢迎社会各界提出宝贵的意见和建议。
法规链接:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=314846

来源:AnyTesting


