您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-06-24 14:28
在仿制药的开发工作中,常常出现同一品种多个规格的情况。根据现有的法规,同一品种,多个规格,可以在符合一定条件的情况下,进行BE工作的豁免。即:多个规格中,仅进行一个规格的BE研究,其他规格免去BE要求。我们来看下FDA和CFDA对于规格不同豁免的指导原则。
FDA:An in vivo BE requirement for one or more strength(s) can be waived based on:
(i) Linear elimination kinetics has been documented over the therapeutic dose range.
(ii) The higher strengths of the test and RLD products are proportionally similar to their corresponding lower strength. ·
(iii) Comparative dissolution testing on the higher strength of the test and RLD products has been submitted and found to be acceptable.
CFDA:若同时满足以下条件,其他规格制剂的生物等效性试验可豁免:
1)在治疗剂量范围内具有线性药代动力学特征;
2)受试制剂和参比制剂的最高规格与其较低规格的制剂处方比例相似;
3)受试制剂和参比制剂最高规格的溶出试验比较结果显示两制剂溶出曲线具有相似性。
制剂处方比例相似是指以下情况:
1)不同规格之间所有活性和非活性组分组成比例相似。
2)对于高活性的药物(原料药在制剂中所占重量比例低):①不同规格的制剂重量一致(差异不超过10%);②各规格使用相同的非活性组分;③规格的变更系通过改变活性组分的用量以及一个或多个非活性组分的用量来实现。
其他的都好理解,但无论是FDA还是CFDA公布的指导原则,里面的“受试制剂和参比制剂最高规格的溶出试验比较结果显示两制剂溶出曲线具有相似性”,这句是最让人头疼的。因为这个指导原则,并没有指出这个“溶出试验的相似”,是怎么个相似,是一片比一片,还是一片比N片。所以现在实际研究中,分成了两派:等剂比(一片比一片)和等量比(一片比N片)。
到底溶出是一片比一片,还是一片比N片,这是目前多规格仿制药研究中,药学工作争议巨大的问题。针对这个问题,笔者思考如下:
1. 一种药物,如果它的药代动力学呈现线性特征,那么不同规格的药物在体内的与BE相关的药动学参数应该是线性的。举个例子,见下表(虚拟值)。
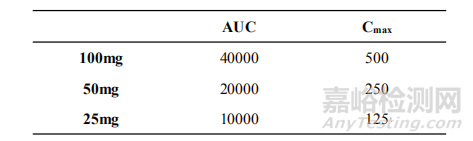
根据上表例,吃了50mg的药物,药动学参数理论上就是100mg的一半。此时,药动学参数和规格是对等的。也就是说,如果这一药物满足药代动力学线性,各个规格的AUC和Cmax可以从某一规格中得知。因此,不需要全部进行BE研究。
这也正是FDA和CFDA的指导原则,第一条都是“药代动力学线性”的原因。
2. 注意上面部分“此时”二字,此时,是指的原型药物。大家知道,制剂的赋型,有可能会带来药动学参数表观值的变化。因此,对于一个制剂成品来讲,需要相同的处方组成,来消除辅料可能带来的影响。 所以指导原则的第二条要求,各规格制剂的处方比例相似。
高活性的药物因为往往规格小,不能进行同一处方制备多个规格(这样会出现某一规格重量特别大或者特别小),所以要求在规定的范围内认为处方比例相似。从这个角度来讲,仅有小规格药物,等重量可以进行BE豁免,而若非小规格,等重量制剂,是不能进行大小规格BE豁免的。
3. 通过上述两项,不知道是否说清楚可以进行BE豁免的原因。下面引入关键的内容:体外曲线比对。
体外溶出曲线的研究,是用来体现药物制剂溶出特征的。同样一个原料,不同的辅料组成,不同的制剂工艺,溶出特征未必一致。本文中所指的大小规格,由于使用了同一个处方工艺,理论上,不同规格的溶出特征应该一致,这从体外证实了辅料背景的消除。辅料背景消除后,满足了线性药动学特征,即可进行BE豁免。
这一溶出特征的一致,应该指的是药物从制剂中释放的特征一致。释放特征一致,应该是100mg规格放到900ml介质里溶出的样子,和50mg放到450ml介质里溶出的样子是一样的。
一块糖和半块糖,放在同样多的一杯水里,是不会溶化的一样快的。这种溶化速度的不一致,不能说明一块糖和半块糖不是同一个质量。在同样体积的一杯水中,半块糖溶解时的浓度梯度要比一块糖大,半块糖往往溶解的快。应该让二者具有相同的浓度梯度,才能保证这个鉴别是公正的。一块糖放在一杯水里,半块糖放在半杯水里,这个时候才能鉴别出溶化的快慢。
笔者尝试借用最常见的药剂学溶出公式,进行一下科学性的解释。

F2比较的本质是比溶出速度,这应该没有更多争议。现在以两规格2倍规格差为例,见下表。
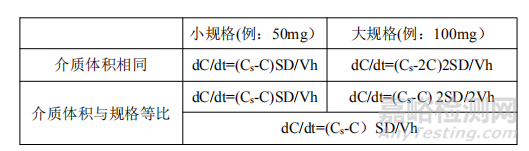
由上述内容可见,两规格若为同一个处方,在比较溶出速度的过程中,介质体积与规格成正比,才可以反应产品的真实情况,才可以确认这是同一个处方做出来的药物。即:100mg用900ml介质,那么50mg应该用450ml介质。
如果做不到100mg/900ml,50mg/450ml,那么50mg*2/900ml 才是需要研究的。100mg/900ml VS 50mg/900ml 不能作为大小规格体外溶出曲线相似的研究方案。正如不能用同样体积的一杯水,区分一块糖和半块糖哪个溶化的快。
各位同仁可以总结下,如果两个规格差得特别多,有多少人一片比一片F2对上了的?10mg和20mg可能可以勉强对上,10mg和50mg对上的有多少?再试试5片10mg和一片50mg,是不是好得不得了?
笔者曾经有过两个做大小规格的经历。第一个案例:片剂,两个规格,10mg和20mg,此时,一片比一片的F2是对不上的,由于战术是要一片比一片,没办法后来把10mg强行压硬,本来5kg的硬度,压到了11-12kg,勉强把曲线对成了50-60;第二个案例:片剂,两个规格,一个50mg,一个200mg,这个时候,无论怎么把片压硬,怎么把衣包厚,都没用,F2对不上。
值得一提的是,这两个品种,无论是原研还是自制,等量比的F2都非常好。四片50mg和一片200mg的溶出曲线对得很好。
还有更关键的一条,我们比F2的目的是什么?比F2是为了生物等效。F2对上了,提示两个制剂生物等效。如果一个品种,两个不同规格的F2对上了,那岂不是这两个规格生物等效?如果一个品种的25mg和100mg一片比一片F2对上了,那岂不是这两个规格生物等效?岂不是吃25mg和吃100mg一样?
也许有人会用F2和体内无关来解释。笔者想说F2和体内的关系是另一个话题; 倘若F2和体内无关,那么不同规格BE豁免的体外溶出研究亦无意义,这已经不是本文讨论的内容了。
综上,笔者认为,用于大小规格BE豁免的体外研究工作,正确的做法是:
1. 先确定该品种药代动力学线性。这是不同规格豁免的首要条件,如果药代动力学不是线性,BE豁免无从谈起。
2. 各个规格用的是同一个处方。或者,品种属于小规格,辅料的调整在规定的范围内。
3. 等量比溶出。不是等剂比。
笔者成文仓促,未能按照科学论文格式撰写,请谅解。仅做发言文稿,欢迎交流!
参考文献
【1】Bioequivalence Studies with Pharmacokinetic Endpoints for Drugs Submitted Under an ANDA, P9L5
【2】以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则

来源:苏沃雷生、药事纵横


