您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-07-24 10:23
前言
随着MDR强制执行的脚步越来越近,欧盟主管当局也在攒足劲儿开展相关工作,来保证新法规的顺利实施。仅在2019年上半年,MDCG就出台了8份指南文件,在6月份更是连发了3份文件,其努力程度可见一斑。其中,MDCG 2019-8是关于MDR条款18中植入卡的要求,小编今天就跟大家一起来了解其中的具体要求。
MDR条款18对植入卡的要求
MDR在条款18中规定,植入器械的制造商应该同时提供器械及识别器械的相关信息(如名称、序列号、UDI、器械型号、制造商名称和地址)、警示信息、预防措施、预期寿命、确保患者安全使用的相关信息等。这些信息要考虑成员国间的语言差异,同时应具备较强的可读性,特别是针对非专业人士。除了缝合线、U形钉、牙科填充物、牙齿矫正器、牙冠、骨板骨钉、导丝、销、夹子等外,其它植入器械都要满足条款18的要求。
针对条款18提出的这些要求,MDCG指南文件在此基础上,还要求植入卡包含医疗机构或医护提供者填写的其他描述信息。
引入植入卡的三大目的
通过引入植入卡,主要可以实现三个目的:
使患者能够识别植入器械并获取与器械相关的其他信息(如通过EUDAMED数据库和其他网站);
使患者能够将自己标识为在相关情况下(如安全检查)需要特殊护理的对象;
在紧急情况下,能够让急救人员了解患者的特殊护理/需求。由此可见,植入卡可以给患者在日常生活中带来非常多的好处,同时也能帮助患者有效地规避风险。
由制造商及医疗机构提供和增加的植入卡信息
根据指南文件要求,制造商需要在植入卡(Implant card, IC)上提供以下信息:器械名称、序列号或批号,UDI(包括机器可读部分,如条形码、二维码等,以及人可读的UDI-DI部分),制造商名称、地址和网址,器械类别(如起搏器、髋部植入物等)。
与此同时,医疗机构或医护提供者需要在植入卡的空白处,提供病人姓名或ID号、实施植入手术的医疗机构或医护提供者的姓名和地址、以及植入时间。
其中,每一部分的信息都应该是易辨别的,同时在信息前都需要匹配对应的符号。另外,制造商及医疗机构在植入卡上提供的信息都应该以欧盟认可的官方语言进行描述。植入卡的外形尺寸应与信用卡、ATM卡或ID卡相同(尺寸为:85.60mm×53.98mm;或3 3/8×2 1/8英寸)。
植入卡常用符号
为了避免不同国家之间出现不同版本的植入卡,该指南文件建议在植入卡上统一使用以下符号:
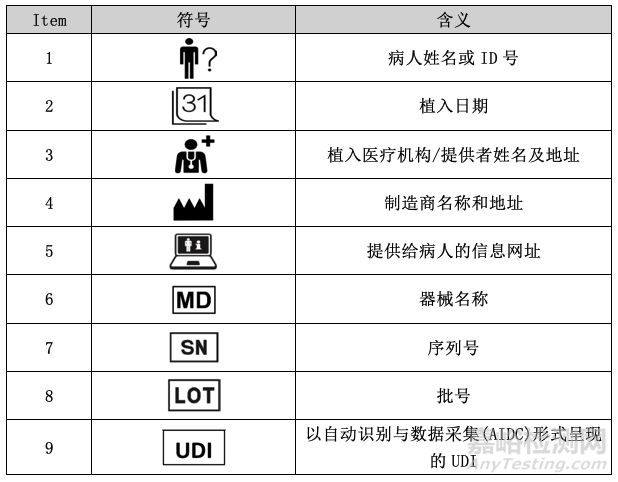
为了进一步解释使用符号的含义,该指南文件建议制造商除了提供器械和植入卡外,还应提供宣传手册,让医护人员能够准确了解植入卡的相关信息,并作为风险管理措施之一。
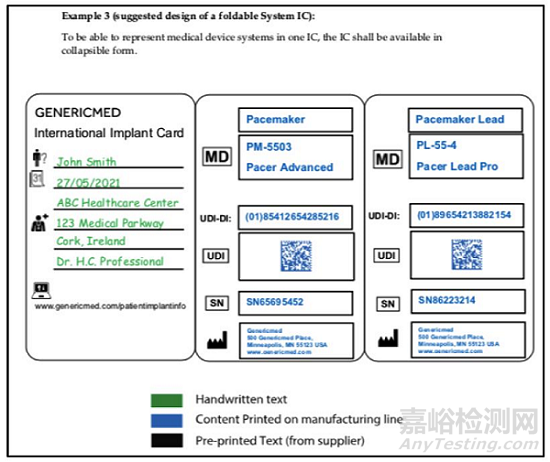
植入卡及宣传手册的示例
指南文件在附录1列举了设计植入卡和宣传手册的四个实例,这些例子能够帮助大家更好地理解法规要求。比如通过例1,大家可以知道,一张植入卡的形状应符合ISO/IEC 7810 ID-1的要求,长为85.6mm,宽为54mm;其正面会包含医疗机构提供的资料,通过之前符号介绍,我们就知道在每一行应该填写什么信息;而植入卡的背面则是制造商提供的信息,大家可以选择提供序列号(如例1)或者产品批号(如例2)。

而例3则针对医疗器械系统,展示了折叠式的植入卡,即同一张植入卡中包含多个植入器械的信息。
最后一例子是关于宣传手册的设计,厂商可以选择三种形式,第一种是非贴纸形式,第二种是仅针对器械类别使用贴纸,最后一种是完全使用贴纸。不管选择哪种形式,宣传手册的背面都是关于符号含义的解释。


总结
通过本文介绍,小编相信大家对于植入卡的要求有了一定了解。如果是做植入器械的厂商,更要结合MDR条款18的法规要求,好好读读MDCG 2019-8这份指南文件。随着新法规MDR执行的不断临近,MDCG后续肯定会出台更多的指南文件,大家一定要多多关注,紧跟步伐,不要掉队。

来源:启升资讯


