摘要:目的:对血管内皮生长因子抑制剂(VEGF Trap)结合活性试验两种结果分析方法进行比较,以考察两者的差异。方法:采用固定剂量的VEGF与系列稀释的VEGF Trap处理之后,检测未结合的VEGF的量,分别以未结合的VEGF量对VEGF Trap浓度梯度和未结合的VEGF检测板的OD值对VEGF Trap浓度梯度进行四参数方程拟合,两种方法计算该产品的结合活性。结果:两种方法均满足试验有效性条件,且血管内皮生长因子抑制剂供试品和标准品的半数抑制浓度(IC50)均分别为3.68和3.6pmoL·L-1,供试品的结合活性为102%。结论:证明了两种分析方法得到的结果完全一致。为同类产品结合活性计算方法的选择提供借鉴。
血管内皮生长因子抑制剂(VEGF Trap)是具有VEGF阻断作用的重组蛋白,由两种不同的人VEGF受体VEGFR1和VEGFR2的细胞外区域融合到人免疫球蛋白IgG1的Fc部分组成。对VEGF-A、VEGF-B和PlGF等因子有较好的亲和力。血管内皮生长因子抑制剂通过与上述因子的紧密结合,降低血管通透性,进一步抑制新生血管的生成。目前,该产品已经在美国、欧盟、日本及中国上市,主要用于治疗年龄相关性黄斑变性(Age Related Macular Degeneration,AMD)、视网膜静脉阻塞(Retinal Vein Occlusion,RVO)继发黄斑水肿,以及糖尿病黄斑水肿(Diabetic Macular Edema,DME)等[1-4]。
前期已建立了VEGF Trap的质控方法和质控标准用于其质量控制[5-6]。其中结和力是VEGF Trap性能参数中一个重要的指标,是质量控制的关键[7-9],采用的方法是将固定量的VEGF与系列稀释的VEGF Trap处理之后,再检测未结合的VEGF的量,该法虽增加了预先结合的步骤,但下一步检测时采用商业化的试剂盒,干扰因素少,商业化抗体与被检抗体相互验证,结果更加真实、客观[10-11]。
本研究比较了VEGF Trap结合活性试验中两种结果的分析方法,以考察两者之间的差异,为同类产品结合活性试验结果分析方法的选择提供借鉴。
1 材料与方法
1.1 试验材料及仪器
VEGF Trap标准品和一个批次的1支VEGF Trap供试品均为本科室留样;重组人VEGF165(货号293-VE)和Quantikine Human VEGF ELISA试剂盒(编号DVE00)均购自美国R&D Systems公司;BSA(编号12659)购自德国默克公司;脱脂奶粉(编号232100)购自美国BD公司;SpectraMax Gemini XS酶标仪及SOFT MAX分析软件为美国Molecular Devices公司产品。
1.2 结合试验酶标板的包被
在96孔酶标板每孔加入300 μL封闭剂(含0.1%BSA和5%脱脂奶粉的PBS溶液),于室温放置至少2 h,使用前用PBS洗涤4次。
1.3 供试品的制备
用稀释液(含0.1% BSA的PBS溶液)将VEGF Trap标准品和VEGF Trap供试品稀释至1 nmoL·L-1(其相对分子质量为97000);将VEGF165稀释至0.2nmoL·L-1(其相对分子质量为42000),在结合试验中作为固定量的VEGF165;将VEGF165稀释至1 nmoL·L-1,用于绘制标准曲线。另配制320 pmoL·L-1和48 pmoL·L-1的VEGF165溶液,用于质控。另取一块新的96孔酶标板作为稀释板,在该板中加入用稀释液制备好的1 nmoL·L-1 VEGF Trap供试品和标准品进行2倍系列稀释,共10个稀释度,同时设置空白对照孔,每个供试品做3个重复孔。
1.4 结合板的制备
取包被好的96孔酶标板作为结合板,将稀释好的VEGF Trap供试品和标准品25 μL加至该板的孔中,每孔再加入165 μL稀释液和10 μL的0.2nmoL·L-1的VEGF165溶液。混匀,室温下孵育12~20 h。
1.5 VEGF165标准曲线及质控孔的制备
用稀释液对1 nmoL·L-1的重组人VEGF165进行2倍系列稀释,共7个稀释度,同时设空白对照孔。取稀释好的上述溶液10 μL,加至结合板的孔中,每孔加入190 μL稀释液,用作VEGF165标准曲线制备。在结合板的新孔中再分别加入320和48 pmoL·L-1的VEGF165溶液25 μL,再向各孔中加入175 μL稀释液,制得40和6 pmoL·L-1的VEGF165溶液,作为试验中VEGF165溶液高浓度和低浓度质控孔。混匀,室温下孵育12~20 h。
1.6 游离VEGF165的检测
从结合板中取出100 μ L结合液,加入Quantikine® Human VEGF检测板中,采用双抗体夹心ELISA法,按试剂盒说明书检测结合后游离VEGF165。
1.7 结果分析方法
1.7.1 方法一
使用Molecular Devices酶标仪,在450 nm处测定VEGF165检测板各孔的A值。根据VEGF165的标准曲线计算VEGF Trap供试品和标准品各浓度梯度下未结合的VEGF165的量。然后以VEGF Trap供试品及标准品浓度的对数值为横坐标,对应的VEGF165含量值为纵坐标,进行四参数方程曲线拟合。计算供试品和标准品的半数抑制浓度(IC50),按照公式:结合活性(%)=供试品的IC50/标准品的IC50×100%,计算出供试品的结合活性。
1.7.2 方法二
使用Molecular Devices酶标仪,在450 nm处测定VEGF165检测板各孔的OD值。以VEGF Trap标准品及供试品浓度的对数值为横坐标,OD450值为纵坐标,进行四参数方程曲线拟合。计算标准品和供试品的半数抑制浓度(IC50),按照公式:相对结合力(%)=供试品的IC50/标准品的IC50× 100%,计算出供试品的结合活性。
1.8 试验有效性
VEGF标准曲线线性回归分析R2值必须不低于0.98;40 pmoL·L-1VEGF165质控的3个重复孔中,应有2个在28~52 pmoL·L-1;6 pmoL·L-1 VEGF165质控的3个重复孔中,应有2个4~9 pmoL·L-1。标准品与供试品结合曲线的非线性回归分析R2值必须不低于0.98;标准品的IC50值必须在2~5 pmoL·L-1。只有同时满足上述条件时,才视为试验有效。按下式计算VEGF Trap的相对结合力,65%~135%为合格。
2 结果
2.1 方法一
在450 nm下测定结合板每一个孔的吸光度值。根据VEGF165标准品的浓度值及吸光度值绘制VEGF165标准曲线,分别计算出质控点VEGF Trap供试品和标准品各浓度梯度下未结合的VEGF165的量,结果如表 1及表 2所示。
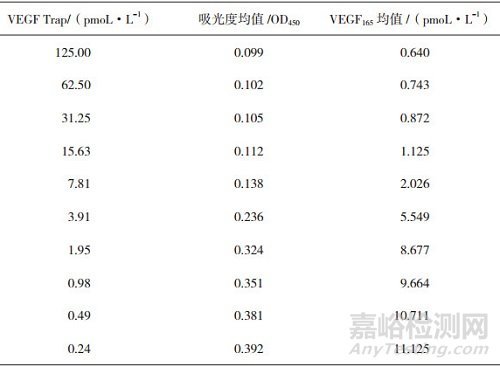
表 1 VEGF Trap标准品各浓度梯度下未结合的VEGF165的量
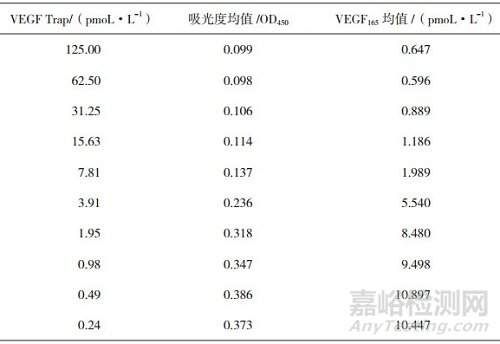
表 2 VEGF Trap供试品各浓度梯度下未结合的VEGF165的量
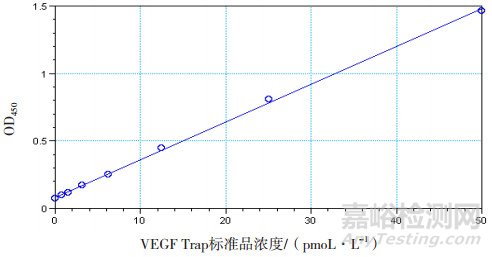
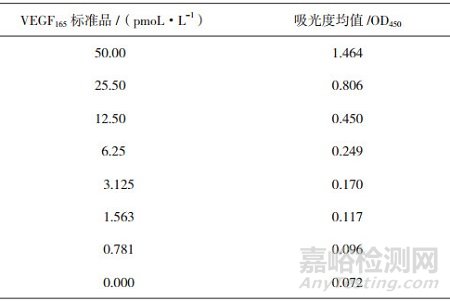
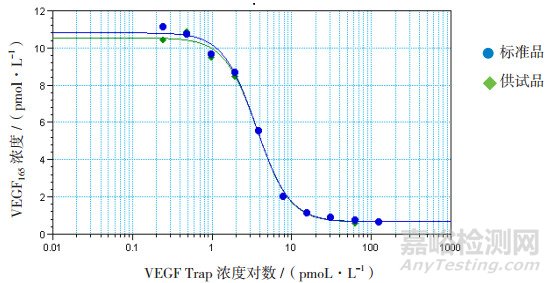
VEGF165标准曲线线性回归方程:Y=0.081+0.028x,R2值为0.999,曲线如图 1所示;VEGF165标准品各个浓度与吸光度值的对应关系如表 3所示;40 pmoL·L-1VEGF165质控的3个重复孔值分别为46.12、46.31、43.66 pmoL·L-1;6 pmoL·L-1 VEGF165质控的3个重复孔值分别为5.32、5.69、6.10 pmoL·L-1。以VEGF Trap供试品及标准品浓度的对数值为横坐标,对应的VEGF165含量值为纵坐标,进行四参数方程曲线拟合,分别绘制供试品和标准品的曲线,求出供试品和标准品的半数抑制浓度分别为3.68和3.6 pmoL·L-1,标准品与供试品结合曲线的非线性回归分析方程:Y=9.961/(1+x/3.68)2.11+0.639,R2值为0.997,如图 2所示。以上均满足该试验的有效性条件,所以试验有效。计算供试品的结合活性为102%。
图 1 VEGF165标准曲线
表 3 VEGF165标准品浓度及吸光度值
图 2 未结合的VEGF165与VEGF Trap浓度对应关系曲线
2.2 方法二
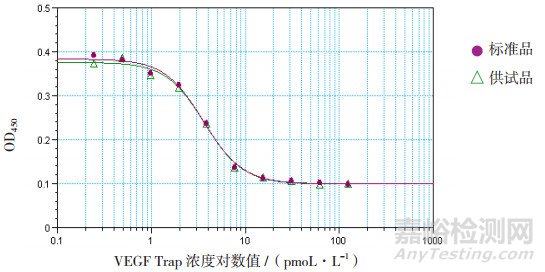
在450 nm直接测定VEGF165检测板各孔的吸光度值。直接以VEGF Trap标准品及供试品浓度的对数值为横坐标,OD450值为纵坐标,进行四参数方程曲线拟合,曲线如图 3所示。标准品与供试品结合曲线的非线性回归分析的R2值分别为0.997。回归方程:y=0.2771/(1+x/3.68)2.11+0.0989。计算供试品和标准品的半数抑制浓度(IC50)分别为3.68和3.6 pmoL·L-1,VEGF165标准曲线和各个质控孔的值同上。均满足试验有效性条件,计算供试品的结合活性为102%。
图 3 未结合的VEGF165吸光度值与VEGF Trap浓度对应关系
3 讨论
经过两种方法的对比表明,以VEGF Trap标准品及供试品浓度的对数值为横坐标,以未结合的VEGF165的量值或直接以未结合的VEGF165的吸光度值为纵坐标,计算得到的VEGF Trap的结合活性一致。
结合活性的计算方法为待测供试品与标准品IC50(半数抑制浓度)之比,而半数抑制浓度为纵坐标是S形曲线上下渐近线差值中点时,横坐标所表示的值,即其所对应的VEGF Trap浓度;理论上,无论以未结合的VEGF165的量值或直接以未结合的VEGF165的吸光度值为纵坐标,两者所得到的横坐标即对应的VEGF Trap浓度一致,纵坐标VEGF165的量值或未结合的VEGF165的吸光度值本身存在着一定的y=kx+b的直线关系,计算半数抑制浓度时,利用了上下渐近线的差值,使得b值被消除,所以方法一和方法二得到的曲线实际上只是纵坐标被放大了k倍,而对应的横坐标相同,这是两种方法得到相同的结合活性的理论依据。
本研究中,方法二计算上操作简便,不用再将VEGF165的OD值转换成VEGF165的含量值;方法一,虽然要经过计算未结合的VEGF165这一步骤,但转换后四参数的图形的纵坐标变大,且直接以未结合的VEGF165的量来表示更加直观。目前,SoftMax公司有专门的软件GXP,能够通过OD值直接转换成VEGF165的含量值,并绘制VEGF165的含量值对VEGF Trap浓度的四参数曲线,十分方便,但需单独购买该软件,需要一定的成本。
本研究比较了用于VEGF Trap结合力试验的两种计算方法,结果表明,两种方法结果一致,在实践中具体采用哪种方法,可根据实际情况而定。
参考文献
[1]MitchellP, Liew G, Gopinath B, et al. Age-related Macular Degeneration[J]. Lancet, 2018, 392(10153): 1147-1159. DOI:10.1016/S0140-6736(18)31550-2
[2]Curry B, Bylsma G, Hewitt AW, et al. The VEGF Treatment of AMD Switch Study(The vTAS Study)[J]. Asia Pac J Ophthalmol, 2017, 6(6): 481-487.
[3]Mylonas G, PragerF, WetzelB, et al. Anti-vascular Endothelial Growth Factor for Unilateral Acute Idiopathic Maculopathy[J]. Eur Ophthalmol, 2018, 28(2): 256-258. DOI:10.5301/ejo.5001070
[4]Budzinskaya MV, Plyukhova AA, Sorokin PA, et al. AntiVEGF Therapy Resistance in Neovascular Age-related Macular Degeneration[J]. Vestn Oftalmol, 2017, 133(4): 103-108. DOI:10.17116/oftalma20171334103-108
[5]王兰, 饶春明, 陶磊, 等. 血管内皮生长因子抑制剂质控方法和质量标准研究[J]. 药物分析杂志, 2010, 30(6): 977-982.
[6]毕华, 丁有学, 王兰, 等. ELISA法间接检测血管内皮生长因子抑制剂的相对结合力[J]. 中国生物制品学杂志, 2010, 23(6): 657-659.
[7]中国药典: 三部[S]. 2015.
[8]王军志. 生物技术药物研究开发与质量控制[M]. 第三版. 北京: 科学出版社, 2018: 133-135.
[9]饶春明, 王军志. 2015年版《中国药典》生物技术药质量控制相关内容介绍[J]. 中国药学杂志, 2015, 50(20): 1776-1781.
[10]杜向瑞, 韩月然, 陈妍, 等. 前蛋白转化酶枯草溶菌9单克隆抗体抗原结合活性间接ELISA测定方法的建立[J]. 中国生物制品学杂志, 2018, 3(3): 311-314.
[11]席欧彦, 贾二坷, 赵婷, 等. 抗CD47单链抗体制备及抗原结合活性分析[J]. 生物技术, 27(4): 370-377.