您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-10-30 15:28
作者:许慧雯 , 郑佳 , 王慧超 , 兰禹葶 , 余新华
中国食品药品检定研究院, 北京 102629
摘要:
目的:研究在新形势下如何不断完善、构建更好的服务于监管需要和产业发展的医疗器械标准化体系。方法:通过对医疗器械标准化工作面临的新形势、新要求进行分析,从标准管理法规建设、组织架构建设、标准体系建设的角度对医疗器械标准化体系进行研究。结果与结论:通过持续深化标准化工作改革,继续强化医疗器械标准化顶层设计,探索研究医疗器械团体标准管理模式,深入推进医疗器械强制性标准整合、精简工作,从而建立适应新形势、更加科学合理、先进适用、开放兼容、规模适度的医疗器械标准化体系。
关键词:医疗器械 标准化体系 标准管理法规 组织架构
党中央、国务院一直高度重视标准化工作,标准化已上升到国家战略的高度。标准化是为了在既定范围内获得最佳秩序,促进共同效益,对现实问题或潜在问题确立共同使用和重复使用的条款以及编制、发布和应用文件的活动。标准化活动确立的条款,可形成标准化文件,包括标准和其他标准化文件。标准体系是指一定范围内的标准按其内在联系形成的、科学的有机整体[1-2]。2015年,国务院印发《国家标准化体系建设发展规划(2016- 2020年)》,明确了标准化体系包括标准化体制机制、标准体系、标准化技术基础以及标准化服务能力等内容[3-4]。当前,随着标准化工作改革的深入推进,标准化工作越来越受到社会各界的重视,医疗器械标准化工作迎来了新的发展机遇,同时也面临新的挑战。在新形势下,医疗器械标准化工作深化改革步伐坚定有序迈进,医疗器械标准化体系建设全面推进,取得了一系列进展,在医疗器械科学监管中发挥了极其重要的作用。
1 医疗器械标准化工作面临的新形势
1.1 国家关于标准化的法规文件相继出台
2015年3月,国务院发布《深化标准化工作改革方案》,拉开了深化标准化工作改革的序幕。历经1 5年修订的《中华人民共和国标准化法》(以下简称《标准化法》)于2018年1月1日开始正式实施,将标准化工作改革的各项措施固化于法,使改革有法可依、于法有据;同时,也对各行业主管部门和标准化工作提出了更高、更严、更具体的要求[5]。《标准化法》规定,国务院有关行政主管部门依据职责负责强制性国家标准的项目提出、组织起草、征求意见、技术审查和监督实施,即医疗器械强制性国家标准的提出单位和归口单位由原来的各医疗器械标准化(分)技术委员会(以下简称“技委会”)调整为国家药品监督管理局,明确了征求意见和技术审查不直接由技委会组织开展,应由国家药品监督管理局组织或委托组织[6]。随着《标准化法》的配套规章和规范性文件《全国专业标准化技术委员会管理办法》《团体标准管理规定》相继出台,对如何进一步加强技委会和医疗器械团体标准的管理,充分发挥技委会和团体标准在医疗器械标准化体系建设中的作用提出了新的课题[7]。
1.2 医疗器械产业发展迅猛
改革开放40年来,我国医疗器械行业已取得长足发展,成为世界范围内医疗器械的主要生产国和消费国之一。从过去5年我国医疗器械行业的总体来看,医疗器械行业规模以上生产企业主营收入复合增速在20%左右,明显高于国际医疗器械行业3%的增速,也明显高于同期国民经济发展的增幅,高端医疗器械研发生产形势喜人,创新产品加速涌现[8-9]。随着经济的快速发展和人们健康意识的不断提高,技术创新、产业升级给作为医疗器械监管重要技术支撑的医疗器械标准化工作提出了新的要求,也带来了新的挑战。
2 新形势下医疗器械标准化体系建设进展
2.1 医疗器械标准管理法规体系逐步健全
我国医疗器械标准化工作一直遵循《标准化法》《医疗器械监督管理条例》。2017年,按照医疗器械监管和标准化工作改革的新要求,原国家食品药品监督管理总局先后对《医疗器械标准管理办法》(以下简称《办法》)和《医疗器械标准制修订工作管理规范》进行修订并发布实施[10-11],改革了原有的医疗器械标准体系,改进了医疗器械标准制修订的工作机制,强化了医疗器械标准的实施监督,更好地发挥标准化在推进医疗器械科学监管中的基础性、战略性作用,进一步夯实了医疗器械标准化工作的法规管理基础,构建了适应于医疗器械标准化工作的医疗器械标准管理法规体系,如图 1所示。
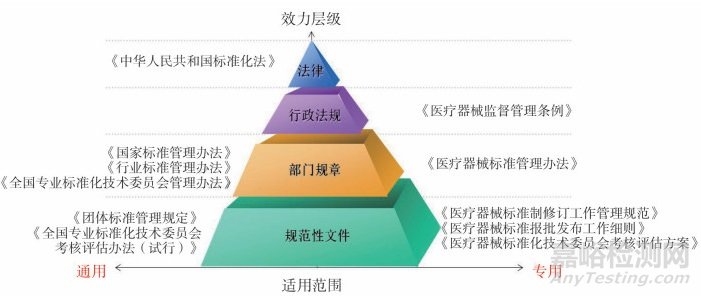
图 1 医疗器械标准管理法规体系图
2.2 医疗器械标准管理组织架构逐步完善
2.2.1 医疗器械标准管理组织架构确立
根据《标准化法》,国家标准化管理委员会统一管理全国标准化工作,国家药品监督管理局分工管理医疗器械标准化工作。为了促进医疗器械标准化工作更好地适应医疗器械监管需要和产业发展,《办法》第十三条规定“在现有技委会不能覆盖的专业技术领域,国家药品监督管理局可以根据监管需要,按程序确定医疗器械标准化技术归口单位(以下简称“技术归口单位”)。技术归口单位参照技委会的职责和有关规定开展相应领域医疗器械标准化工作”。按照《办法》,医疗器械标准管理组织架构包括国家药品监督管理局,国家药品监督管理局医疗器械标准管理中心,地方药品监管部门,技委会及技术归口单位,医疗器械研制机构、生产经营企业和使用单位5个主体。其中,技委会和技术归口单位具体承担医疗器械标准制修订工作。
2.2.2 技委会及技术归口单位建设
经过“十一五”“十二五”“十三五”的发展,医疗器械领域技委会从“十五”末的19个发展到如今共有24个技委会、3个技术归口单位。为贯彻实施国家加快发展战略性新兴产业的决定,2018年,全国外科植入物和矫形器械标准化技术委员会有源植入物分技术委员会和全国医疗器械生物学评价标准化技术委员会纳米医疗器械生物学评价分技术委员会2个技委会,以及医用电声设备、医用增材制造技术、人工智能医疗器械3个标准化技术归口单位,已分别获国家标准化管理委员会和国家药品监督管理局批复同意正在组建中。为充分发挥新形势下医疗器械标准的引领作用和技术支撑作用,在医用机器人等战略性新兴技术领域和医疗器械优势学科领域,积极筹建相应的技委会或技术归口单位[12]。
2.3 医疗器械标准化体系逐步优化
2.3.1 医疗器械标准化体系架构明晰
《标准化法》第二条明确规定“国家标准分为强制性标准、推荐性标准,行业标准、地方标准是推荐性标准。”但第十条在将强制性国家标准严格限定在保障人身健康和生命财产安全、国家安全、生态环境安全和满足社会经济管理基本要求的范围之内的同时,明确规定了“法律、行政法规和国务院决定对强制性标准的制定另有规定的,从其规定”的例外情况。《深化标准化改革方案》规定“法律法规对标准制定另有规定的,按现行法律法规执行。环境保护、工程建设、医药卫生强制性国家标准、强制性行业标准和强制性地方标准,按现有模式管理。”目前,医疗器械标准与环境保护、工程建设等仍保留了强制性行业标准[13]。根据《办法》中医疗器械标准的定义,由于团体标准、企业标准等并非由国家药品监督管理局组织制修订,故暂未纳入现有医疗器械标准化体系。因此,医疗器械标准从效力和层级来区分包括强制性国家标准、强制性行业标准和推荐性国家标准、推荐性行业标准。按规范对象,医疗器械标准分为基础标准、产品标准、方法标准和管理标准。
2.3.2 医疗器械标准规划引领和战略布局强化
2018年1月29日,原国家食品药品监督管理总局印发了《医疗器械标准规划(2018 -2020年)》,确定一个思想、提出一个目标、坚持三项原则、聚焦三大领域、实施四大保障、部署六大任务,紧贴医疗器械科学监管的标准化需求,聚焦医疗器械标准突出问题,对2018-2020年医疗器械标准化体系建设做出了全面部署,为医疗器械标准制修订发展方向做出了顶层设计,强化医疗器械标准化体系的宏观指导。
2.3.3 医疗器械标准化体系结构不断优化调整
按照国家深化标准化工作改革的精神,从标准立项的源头管理入手,提出产品标准原则上不宜做强制性标准,管理标准、方法标准和产品标准原则上为推荐性标准的立项原则,进一步落实医疗器械强制性标准整合、精简结论和推荐性标准集中复审意见,推动医疗器械标准化体系结构优化调整。从近3年医疗器械行业标准立项情况来看,2019年立项项目中采用国际标准项目占立项项目的27%,而强制性标准仅5项,主要为基础通用标准和强制性标准修订项目,占立项项目的5%,强制性标准占比连续3年持续下降,如图 2所示。2018年,批准发布医疗器械国家标准11项、行业标准104项;其中,强制性标准17项,占全年发布标准总数的15%;基础通用和管理标准8项,方法标准31项,共占全年发布医疗器械标准总数的34%,如图 3所示。在2018年发布的标准中,9项医疗器械行业标准由强制性修订为推荐性,3项医疗器械行业标准为整合修订。截至2019年6月12日,医疗器械强制性标准占比已由2010年的48%下降至27%,强制性标准数量逐年下降。
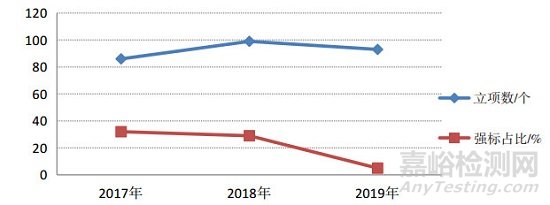
图 2 2017-2018年强制性医疗器械行业标准立项占比趋势图
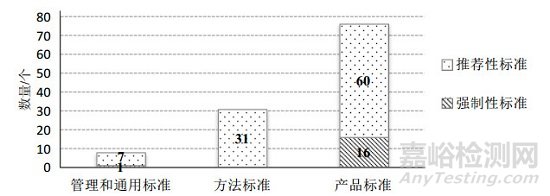
图 3 2018年发布医疗器械标准分布图
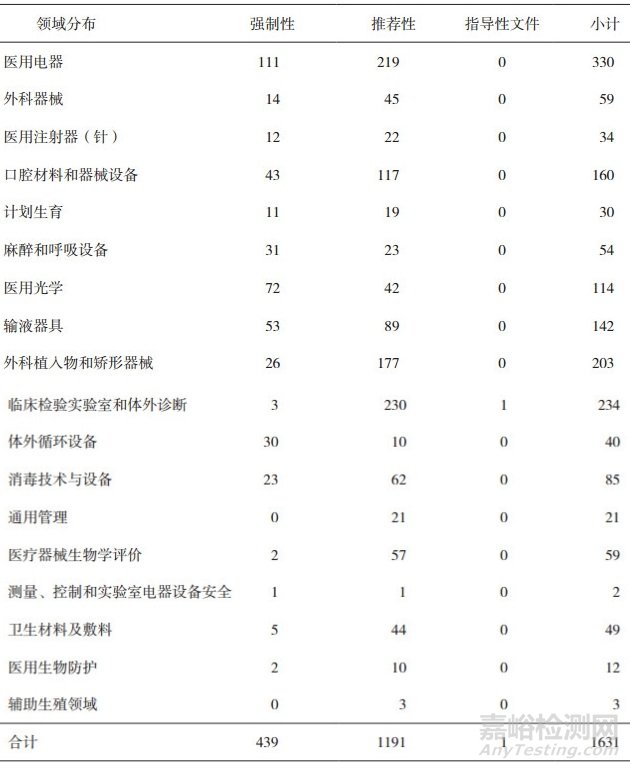
截至2019年6月12日,我国现行有效医疗器械标准共1631项, 包括国家标准219项(强制性86项,推荐性132项,指导性文件1项)和行业标准1412项(强制性353项,推荐性1059项),基本覆盖了医疗器械各技术领域(见表 1)。
表 1 医疗器械标准统计表
3 医疗器械标准化体系下一步研究重点
3.1 强化标准化顶层设计,建设更加先进适用的标准化体系
2019年是深化标准化工作改革第三阶段开局之年,是“十三五”规划承上启下的关键之年,也是“十四五”规划的谋划布局之年。医疗器械标准化体系建设工作将配合《医疗器械监督管理条例》修订工作,积极参与《“十四五”国家药品安全规划》《中国标准2035》的编制,提前布局,从顶层设计制定医疗器械标准化发展战略[14]。
3.2 深化标准化工作改革,建设更加科学合理的标准化体系
一方面强化立项源头管理,对监管急需、基础通用标准、高风险类产品标准、采用国际标准、修订标准的医疗器械申请项目优先立项。另一方面,进一步明确医疗器械强制性标准的范围、作用与定位,持续推进强制性标准整合精简和推荐性标准集中复审结论落实,优化调整存量标准体系结构。保证医疗器械强制性标准重在兜底线、保基本,作为执行法规的有益补充和技术依据,促进医疗器械推荐性标准逐步向具有广泛适用性或特定技术领域基础通用要求的公益类标准过渡,侧重强制性标准配套的基础通用标准、管理标准或方法标准,逐步缩减产品标准,为生产企业满足法规要求、提升产品质量提供有益指导。
3.3 探索研究团体标准管理模式,建设更加开放兼容的标准化体系
根据《团体标准管理规定》第五条“国务院有关行政主管部门分工管理本部门、本行业的团体标准化工作”和第三十三条“对于已有相关社会团体制定了团体标准的行业,国务院有关行政主管部门结合本行业特点,制定相关管理措施,明确本行业团体标准发展方向、制定主体能力、推广应用、实施监督等要求,加强对团体标准制定和实施的指导和监督”,结合医疗器械行业特点,制定相关管理措施,使团体标准发展与行业的法律法规、强制性标准、有关产业政策相协调。加强对团体标准制定和实施的指导与监督,积极探索医疗器械团体标准的管理模式;另一方面,根据《团体标准管理规定》第二十八条“团体标准实施效果良好,且符合国家标准、行业标准或地方标准制定要求的,团体标准发布机构可以申请转化为国家标准、行业标准或地方标准。”积极探索医疗器械团体标准申请转化为医疗器械国家标准、行业标准的机制,以增加医疗器械标准的供给。建立政府主导制定标准与市场自主制定标准协同发展、协调配套的新型标准化体系框架。
4 结语
习近平同志曾明确指出:“标准化建设对经济社会发展具有长远的意义,要积极实施知识产权和标准化战略”。标准化作为国家治理体系和治理能力现代化建设的基础性制度,充分发挥标准化的基础性、战略性作用,对于进一步提高国家治理水平和效率、推进国家治理体系和治理能力现代化具有重要意义。法律主要回答“可为”还是“不可为”的问题,而标准主要回答“如何为”的问题,具有较强的可操作性。与刚性的法律相比,标准更加具体细致,是法律法规的细化和延伸, 是国家治理的基础性规范[15]。为切实做好新形势下医疗器械标准化工作,医疗器械标准化体系建设工作以标准法规管理体系健全为基础,以标准管理组织架构完善为保障,以标准化体系结构优化为核心全面推进。在进一步明确新形势下医疗器械标准化工作的使命和任务的基础上,积极探索建设更加科学合理、更加先进适用、更加开放兼容的医疗器械标准化体系,践行国家标准化战略,用最严谨的标准助力医疗器械科学监管,服务于医疗器械产业发展。
参考文献
[1] 国家质量监督检验检疫总局、国家标准化管理委员会. GB/T 20000.1-2014标准化工作指南第1部分: 标准化和相关活动的通用术语[S].北京: 中国质检出版社中国标准出版社, 2015: 3.
[2] 中国标准化研究院.标准体系表编制原则和要求: GB/T 13016-2018[S].北京: 中国标准出版社, 2018: 2.
[3] 中华人民共和国中央人民政府.国务院办公厅关于印发国家标准化体系建设发展规划(2016-2020年)的通知[S].2015-12-30.
[4] 赵耀. 关于《国家标准化体系建设发展规划(2016-2020年)》的几点思考[J]. 核标准计量与质量, 2016(1): 2-6.
[5] 郭济环. 新时代新法律新征程-新修订《中华人民共和国标准化法》正式实施[J]. 质量与标准化, 2018(1): 6-7. DOI:10.3969/j.issn.2095-0918.2018.01.003
[6] 全国人大常委会办公厅. 中华人民共和国标准化法[J]. 商品经济与标准化计量, 1989(1): 9-11.
[7] 许慧雯, 郑佳, 王慧超, 等. 医疗器械标准管理现状及思考[J]. 中国食品药品监管, 2018(11): 20-25.
[8] 耿鸿武. 技术驱动下医疗器械行业监管新挑战[J]. 中国食品药品监管, 2018(11): 4-7.
[9] 周莹莹, 苑云. 我国医疗器械产业发展现状, 问题及对策[J]. 世界最新医学信息文摘, 2018(70): 249.
[10] 国家食药监总局: 3年内制修订300项医疗器械标准[J].中国质量与标准导报, 2018, (3): 8. http://www.cqvip.com/QK/97680X/201803/674694186.html
[11] 国家食药监总局印发《医疗器械标准规划(2018-2020年)》: 3年内制修订300项医疗器械标准[J].中国标准化, 2018, (5): 35.
[12] 许慧雯, 王越, 杨晓芳, 等. 医疗器械标准体系进展[J]. 中国医疗器械杂志, 2018, 42(1): 49-52. DOI:10.3969/j.issn.1671-7104.2018.01.013
[13] 刘辉. 论《标准化法》中的标准制定[J]. 质量探索, 2018, 15(3): 5-17.
[14] 杨敬丽. "中国标准2035"重大咨询研究项目正式启动[J]. 中国标准化, 2018(7): 45-45.
[15] 高鹰忠. 发挥标准化在国家治理中的重要作用[J]. 中国司法, 2015(12): 5-5.

来源:中国药事


