您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2019-11-24 20:18
作 者:卞蓉蓉,李尧(通信作者),赵敏,马丹华,宋杏芳,杨婷婷
单 位:江苏省药品不良反应监测中心
〔摘 要〕
目的 对医疗器械在各种治疗中形成异物,并遗留在患者体内的不良事件进行研究,对相关数据特征和影响因素进行分析,为降低该类不良事件的发生率提出控制措施和建议。
方法 对2013- 2017年江苏省药品不良反应监测中心收集到的101例医疗器械形成异物遗留在患者体内的不良事件进行统计分析和典型病例阐述。
结果 Ⅲ类医疗器械形成术中遗留异物的报告最多,遗留异物最多部位的前3 名为血管、腹腔和盆腔。50.50%的异物遗留发生后将异物取出;91.09%的不良事件为产品因素导致;59.41%的异物在外科手术中产生。
结论 生产企业应注重产品质量,从材料选择、产品设计、生产工序、包装标识等角度不断提升产品安全性,降低产品形成异物遗留体内的风险。
异物遗留发生在外科手术、输液等治疗过程中,会对患者造成严重伤害,甚至可能危及生命,此类事件与医疗器械有紧密联系,属于严重医疗器械不良事件的范畴[1]。近 年来,临床安全管理部门开始采取诸多防范措施,如进行人员岗前培训、施行术前清点制度、规范手术流程等,此类事件发生数量得以减少,但由于医疗器械本身原因形成体内异物的事件难以避免,如设计不合理、标识不明晰等,异物遗留依然是困扰医院手术室安全的重要问题之一[2-3]。
本研究对江苏省药品不良反应监测中心开展医疗器械不良事件监测工作后收集到的与使用医疗器械形成体内异物有关的病例报告进行汇总、归纳,提出降低该类事件生率的合理建议。
1、资料与方法
1.1 一般资料
选取2013年1月1日至2017年12月31日江苏省药品不良反应监测中心收集的101例医疗器械形成异物遗留体内的可疑不良事件报告。
1.2 方法
采用描述性研究分析方法,参考国家食品药品监督管理总局发布的《医疗器械分类目录》、国家卫生与计划生育委员会发布的《医疗机构手术分级管理办法》,依托江苏省药品不良反应监测中心病例数据库,运用 Microsoft Excel软件,从产品分类、异物遗留部位、形成原因等方面进行统计和分析。
2、结果
2.1 涉及产品情况
对101例报告涉及的产品分别按风险管理类别和名称进行统计,涉及Ⅲ类医疗器械的报告最多,其中,静脉留置针共30例,占总报告数的29.70%。见表1。
表1 产品管理类别及产品名称情况

2.2 异物遗留部位及处理情况
根据报告中不良事件描述,事件发生后采取额外手术将异物取出最多;事件发生后未找到或未能取出异物第二多。按异物遗留发生的部位统计,血管中37例,占36.63%;腹腔中21例,占20.79%;盆腔中8例,占7.92%。见表2。
表2 遗留部位及处理情况
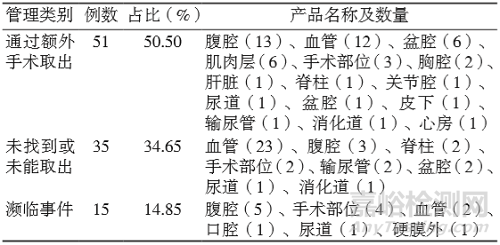
注:濒临事件,指发生时并未造成人员伤害,但再次发生同 类事件时会对患者造成严重伤害
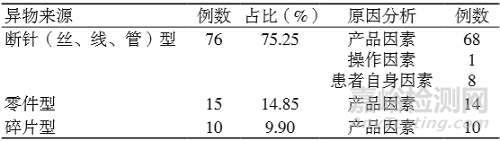
2.3 异物来源及形成原因
对101例报告按异物来源进行统计,并根据事件描述判断异物形成原因。异物来源为断针(丝、线、管)较多。事件为产品因素导致的共92例,占总报告数的91.09%。见表3。
表3 异物来源及形成原因
2.4 发生异物遗留患者的治疗类型
对101例报告按治疗类型进行统计,外科手术中产生异物最多,其次为输液时产生异物。见表4。
表4 治疗类型情况

2.5 异物位置诊断检查方式
排除濒临发生的不良事件报告,对86例报告按异物位置探测的影像检查手段进行统计,未采取影像检测最多,其次为采用X线常规透视检查。见表5。
表5 异物位置诊断检查方式

3、讨论
3.1 风险分析
3.1.1 产品分类与主要伤害
3.1.2 遗留部位、处理措施与风险
按异物遗留发生的部位统计,血管、腹腔部位的报告例数远高于其他部位;而遗留在心室、肝脏、脊柱等重要器官的报告例数较少,这与有关临床研究报道相似[6]。超过1/3的病例报告显示,对遗留异物未能确诊位置或未 能取出。对体内异物原则上均应取出,而且发现后宜尽早手术,腔内异物取出手术可能需要开胸,手术难以定位,风险和伤害极大,所以某些细小散在异物不在重要组织或脏器处,无明显不适症状或取出困难时,可予以保留及观察。
3.1.3 异物来源、手术类型与诊断方式风险
本研究中涉及到异物的来源可以概括为“碎片型”“零件型”“断针(丝、线、管)型”等,数据中未见完整的器械由于失误操作遗留体内的病例。发生异物遗留患者的治疗类型主要为外科手术和输液,各级别外科手术均可能发生异物遗留,包括中医治疗、血液透析治疗等,有文献研究显示急诊手术由于创伤多、手术时间短等原因,更易导致术后异物遗留[7]。异物位置检测方式以X线常规透视和CT断层扫描为主,但常规X线检查容易漏诊,应配合B超、CT、MRI等不同方法深入筛查[8]。
3.2 部分事件处理结果及启示
3.2.1 3例不良事件处理结果
案例一:一次性使用标本取物器从患者体内移出时,发现不锈钢金属薄层已经脱落。经调查,原因是不锈钢材质的纯度不达标。有关企业加强进货检验,避免同类事件 再次发生。
案例二:负压引流球使用7d后断裂在患者体内,深度为距离皮肤约3cm。经调查,该产品表面在生产过程中受到过机械工具割损。生产企业进一步严控生产流程,明确工具的放置不与管身接触。
案例三:一次性针灸针使用时针尖断裂,残留于患者体内。经调查,发现原材料供应商采用对焊后继续拉丝工艺,易留孔造成断针。该企业要求供应商取消对焊工艺,并在出厂检验中采取增加弯曲度测试项目。
3.2.2 案例启示
纳入本研究的病例报告中,90%的上报人将事件发生原因归咎于产品因素,上述3起对可疑医疗器械不良事件的调查处理结果值得深思,生产企业是产品质量第一责任人,在此对有关生产企业提出如下建议:生产企业应确保 生产过程符合规范,严格遵守质量管理体系,从材料选择上,要有合格的纯度、适当的强度和抗疲劳、抗磨损、耐腐蚀的能力,应具有良好的生物相容性,弹性模量要与人体接近;从设计上,应简化植入类医疗器械操作过程,丝线型或软管型的器械,应能避免在体内受到挤压而形成弯曲死角结构,严控焊接部位的工艺和参数,确保焊点的稳固,尽可能提高产品标准;从工序上,加工过程要遵从机械力学原理,注意材料切割方向,提高表面加工质量、光度角,减少加工装配残余应力。同时,要不断完善产品说明书、标签、警示语等,加强操作人员培训,特别是规格型号的选择和操作注意事项。还需按照有关法规,制定完善的医疗器械不良事件收集和事件处理制度,及时采取风险管理措施,改进产品。
4、结语
建议各级监管部门关注医疗器械形成异物遗留类不良事件监测,督促生产企业开展风险评价工作,探索持续改善产品,保障医疗器械的安全有效。
【参考文献】
[1]徐培君.防止异物遗留体内的风险管理[J].当代医学,200(7 11):112-113.
[2]贾凤菊,邵丽.手术室异物遗留病人体内的安全隐患及对策[J]. 全科护理(下旬刊),2008,6(4):348.
[3]刘小霞.防止术中将异物遗留在体腔内的措施[J].吉林医学,2011,32(11):2245.
[4]叶可,李开,吴建群.对《人体损伤程度鉴定标准》关于体内异物存留及医疗手术的理解和建议[A].中国法医学会法医临床专业委员会.中国法医学会·全国第十七届法医临床学学术研讨会论文集[C].中国法医学会法医临床专业委员会, 2014 :3.
[5]侯宁蕊,刘谋珠,史玲玲.术后异物残留风险及预防策略研究进展[J].护理学杂志,2009,24(20):95-97.
[6]王春灵.预防术中异物遗留的研究进展[J].解放军护理杂志,2016,33(12):34-37.
[7]张健,彭文涛.手术医生执行防止异物遗留措施依从性的现状调查[J].当代护士(专科版),2014(7):28-30.
[8]汤勇,李强,王刚,等.彩超定位在四肢金属异物取出中的临床应用研究 [J].中国骨与关节损伤杂志,2012,27(2):177-178.

来源:医疗装备


