您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-29 09:22
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
信迪利单抗降幅超60%入围国家医保。新一轮的国家医保谈判准入药品名单刚刚公布,信达生物的达伯舒(信迪利单抗)以2843元(10ml:100mg/瓶),降幅高达63.73%,成为唯一一个入选2019年国家医保谈判药品名单的PD-1,进入国家乙类医保,限用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者。协议有效期为2020年1月1日至2021年12月31日。参与谈判的品种还包括默沙东公司的Keytruda (pembrolizumab注射液)、BMS的Opdivo(nivolumab注射液)以及君实生物的拓益(特瑞普利单抗注射液)。
国内药讯
1.海正药业克拉屈滨注射液获FDA批准。海正药业旗下克拉屈滨注射液获FDA批准,用于治疗临床上表现为贫血,中性粒细胞减少,血小板减少等症状的毛细胞白血病患者。原研药Leustatin Injection(1mg/mL)由Janssen公司研发,国内外获批的生产厂商有WEST-WARDPHARMS INT、MYLAN LABS LTD、FRESENIUS KABI USA、海正药业等。据统计,克拉屈滨注射液2018年全球销售额约1,535.45万美元,其中美国市场销售额约499.37万美元;2019年1-6月全球销售额约770.22万美元,其中美国市场销售额约229.56万美元。
2.博瑞医药注射用艾司奥美拉唑钠获批。博瑞生物旗下注射用艾司奥美拉唑钠获国家药监局核发的《药品注册批件》。注射用艾司奥美拉唑钠为新一代的质子泵抑制剂,用于作为当口服疗法不适用时,胃食管反流病的替代疗法;用于口服疗法不适用的急性胃或十二指肠溃疡出血的低危患者(胃镜下Forrest分级IIc-III)。目前,该品种国内获批上市的厂家还有阿斯利康、正大天晴、奥赛康药等多家企业。
3.重组人截短型纤溶酶注射液获批临床。江苏璟泽生物、上海景泽生物与成都泽研生物联合提交的重组人截短型纤溶酶注射液获国家药监局临床试验默示许可,拟开发用于治疗症状性玻璃体黄斑黏连的眼底注射制剂,可用于替代玻璃体剥离手术治疗。
4.新医保谈判目录公布:新增70个。2019年《国家基本医疗保险、工伤保险和生育保险药品目录》完整版公布,通过最新谈判,新版国家医保目录新增70个药品,另外有27个药品“续约”。这97个药品将全部纳入医保目录乙类药品范围。新增的70个药品,价格平均下降60.7%;续约的27个药品,价格平均下降26.4%。使得患者个人负担减少80%以上,个别药品负担下降95%以上。其中,三种丙肝治疗用药降幅平均在85%以上,肿瘤、糖尿病等治疗用药的降幅平均在65%左右。
5.三叶草生物完成B轮融资。三叶草生物完成3.04亿元人民币B轮融资。三叶草生物是一家专注于肿瘤和自身免疫性疾病领域的生物制药研发公司,拥有cGMP大分子生物制药生产能力,其独有的Trimer-Tag(蛋白质三聚体化)专利技术平台可开发靶向三聚体化创新生物药。目前拥有一款处于Ⅰ期阶段的重组全人源三聚体融合蛋白SCB-313和另一款即将进入Ⅲ期临床的依那西普生物类似药SCB-808。该轮融资将用于支持其大分子生物制药产品临床开发,新建产业化规模cGMP生产线的运营以及扩展其Trimer-Tag平台开发的研发管线。
国际药讯
1.赛诺菲长效胰岛素获批扩展适应症。赛诺菲长效甘精胰岛素注射液Toujeo获FDA批准扩展适用范围,用于治疗6岁及以上1型糖尿病儿童和青少年患者。欧洲药管局人用药品委员会本月初也建议批准扩展适应症。Toujeo此前仅获批治疗18岁及以上成年患者。一项EDITION JUNIOR研究评估Toujeo治疗6至17岁1型糖尿病患者的疗效,6个月的治疗结果显示,与Toujeo Gla-100相比,Toujeo治疗组中的患者实现降低糖化血红蛋白水平(HbA1c)的非劣效性标准;该组患者中酮症和严重低血糖症(<54 mg/dL)的发生率都相对更低,具有管理血糖波动的有效性。
2.小野制药骨髓瘤药物Kyprolis每周1次方案获批。小野制药开发的蛋白酶体抑制剂Kyprolis(carfilzomib,卡非佐米)10mg和40mg静脉注射液治疗复发或难治多发性骨髓瘤(R/R MM)患者的额外剂量给药方案在日本获批,允许扩大Kyprolis与地塞米松联用的额外剂量给药方案,纳入每周1次给药方案(Kd70)。一项III期研究(ONO-7057-06/ARROW)结果显示,与每周2次27mg/m2剂量Kyprolis联合地塞米松(Kd27)相比,每周1次70mg/m2剂量Kyprolis与地塞米松联用方案(Kd70)使R/R MM患者中位PFS显著延长3.6个月(11.2个月 vs 7.6个月,p=0.0014),总缓解率显著提高(62.9% vs 40.8%,p<0.0001),并具有可比的安全性。
3.拜耳在欧盟申报Xarelto用于儿童抗凝。拜耳向欧洲药品管理局提交了一份申请,扩大抗凝血剂Xarelto(rivaroxaban,利伐沙班)的适应症,用于17岁以下确诊为静脉血栓栓塞(VTE)的儿童,包括脑静脉窦血栓(CVST)。该申请包括治疗VTE以及预防VTE复发。在一项III期临床EINSTEIN-Jr中,17岁以下的VTE儿童患者接受Xarelto(片剂或混悬剂)或标准抗凝治疗,结果显示:Xarelto治疗儿科患者VTE与当前的标准抗凝治疗相比具有相似的复发性VTE风险(1.2%vs3.0%)和相似的低出血率(3.0%vs1.9%),其疗效和安全性与先前在VTE成人患者的研究中观察到的结果一致。
4.Incyte胆管癌创新疗法获优先审评资格。Incyte公司FGFR1/2/3抑制剂pemigatinib的新药申请获FDA受理,用于治疗携带FGFR2基因融合或重排的局部晚期或转移性经治肝内胆管癌(iCCA)患者。FDA同时授予其优先审评资格,预计明年5月30日前作出回复。FDA此前已授予pemigatinib治疗胆管癌的突破性疗法认定和孤儿药资格。一项Ⅱ期临床FIGHT-202结果显示,在携带FGFR2基因融合或重排的局部晚期或转移性经治iCCA患者亚组中,pemigatinib的单药治疗使患者达到36%的客观缓解率,并使中位缓解时间达到7.5个月。
5.Inotrem S.A.公司nangibotide启动IIb期研究。Inotrem S.A.公司在研TREM-1抑制剂nangibotide(LR12)治疗脓毒性休克的全球性IIb期ASTONISH试验启动并入组了首例患者。该研究旨在评估nangibotide的疗效与安全性,以及验证一种个体化的医疗方法,使用可溶性TREM-1作为潜在的伴随诊断测试,识别更多可能受益于nangibotide治疗的患者。该项研究计划入组450例患者。nangibotide此前已获欧洲药品管理局(EMA)授予优先药物资格(PRIME),今年9月FDA也授予其治疗脓毒性休克的快速通道资格(FTD)。
6.NIH与ViiV达成合作。ViiV Healthcare公司与美国国立卫生研究院(NIH)的下属机构国家过敏和传染病研究所(NIAID)达成一项独家许可协议,双方将共同开发和商业化NIAID的在研广谱中和抗体(bNAb)N6LS,用于预防和治疗HIV-1感染。根据协议,NIAID将获得相应的预付款,以及就本次合作研发药物的潜在里程碑付款和在未来的销售额分成。ViiV Healthcare将负责开展Ⅱa期研究,进一步评估N6LS在艾滋病毒携带者中的疗效与安全性。
医药热点
1.去年全球新发170万HIV感染者。2019年全球艾滋病报告发布。报告指出,2018年全球共有170万名艾滋病病毒新发感染者。非洲东部、南部地区青少年、女童及15岁~24岁女性的艾滋病病毒新发感染率,从2010年的0.8%降至2018年的0.5%,降幅达42%;但性别不平等、生殖健康服务有限等因素依然加剧青少年、女童和年轻妇女感染艾滋病病毒的风险。报告显示,从2010年起,非洲除东部及南部以外的地区艾滋病病毒新发感染仅下降4%,东欧及中亚地区每年艾滋病病毒新发感染数上升29%,中东和北非地区上升10%,拉丁美洲增加7%。
2.无偿献血纳入征信系统是加分项。11月26日,在国家卫健委召开的例行新闻发布会上,国家卫健委医政医管局监察专员郭燕红回应了近日关于无偿献血纳入社会征信体系的争议。“无偿献血纳入个人征信系统,是个人信用的加分项目。它不会影响个人的信用,更不会带来惩戒。”郭燕红同时强调,文件在这一提法的前面使用了“探索”一词,就是鼓励各地因地制宜、循序渐进地发挥好社会征信体系褒扬诚信、激励守信的正向作用。
3.加速康复外科试点将展开。国家卫健委发布《加速康复外科试点工作方案(2019-2020年)》提出,将在全国范围内开展加速康复外科试点。试点将在三级综合医院和专科医院,率先由骨科展开,逐步扩大专科及病种范围。《方案》要求,试点医院要将加速康复理念融入有关疾病的诊疗,建立加速康复外科诊疗流程和制度规范。同时,成立加速康复外科工作委员会,建立监督管理和质控评价机制,定期对医院加速康复外科工作情况进行检查,对相关科室开展医疗质量控制和评估评价。
【复星医药】控股子公司上海复星医药产业发展有限公司新药FN-1501用于急性髓性白血病治疗获得FDA孤儿药认定。
【信邦制药】(1)因涉及债务违约事宜,控股股东西藏誉曦的一致行动人誉衡集团近期被动减持了公司部分股份。截至2019年11月27日,誉衡集团已累计减持公司股份1,916.77万股(总股本1.1497%)。(2)公司类型拟从“股份有限公司(中外合资、上市)”变更为“股份有限公司(上市)”。
【华东医药】因公司内部工作岗位调整,马红兰不再担任公司财务负责人职务,公司另有任用,将协助董事长做好内部风险管控工作。聘任邱仁波担任公司财务负责人。
审评动向
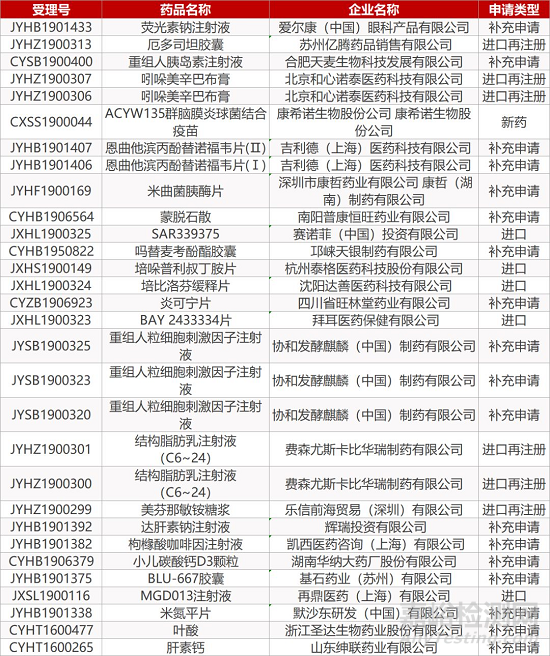
1. CDE最新受理情况(11月28日)
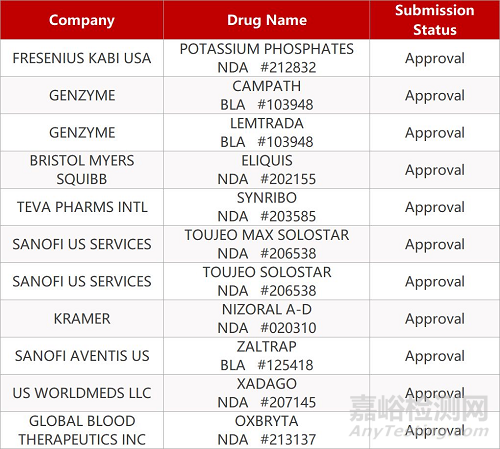
2. FDA最新获批情况(北美11月27日)

来源:未知


