您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-12-09 09:48
在2019年5月之前,和体外诊断试剂临床试验相关的ISO标准是没有的。广大体外诊断试剂的厂商主要去参考各国关于体外诊断试剂临床试验的法规要求,比如NMPA的《体外诊断试剂临床试验指导原则》 。但共识性的标准是没有的。2019年5月,共识性的标准ISO 20916出台了。

那么这个标准的结构是怎么样的呢? 标准的目录写得很清楚,主要分两部分内容:正文和附录。正文包括:
1. Scope 范围
2. Normative references 规范性引用文件
3. Terms and definitions 术语和定义
4. Ethical consideration 伦理考虑
5. Clinical performance study planning 临床性能研究计划
6. Study site initiation 研究地点的启动
7. Clinical performance study conduct 临床性能研究的实施
8. Close-out of the clinical performance study 临床性能研究的总结
9. Auditing 临床性能研究的稽核
附录包括:
Annex A: Additional general requirements for certain studies(某些研究的额外要求)
Annex B: Clinical performance study protocol(临床性能研究的方案)
Annex C: Investigator brochure(研究者手册)
Annex D: Clinical performance study report(临床性能研究的报告)
Annex E: Communication with the ethics committee( 和伦理委员会的沟通)
Annex F: Informed consent(知情同意)
Annex G: Adverse event categorization( 不良事件的分类)
Annex H: Good clinical performance study documentation( GCP的文件要求)
Annex I: Auditing( 临床性能研究的稽核)
标准里面包含这么多内容,我要怎么去看才会比较高效呢?标准中有一张图:
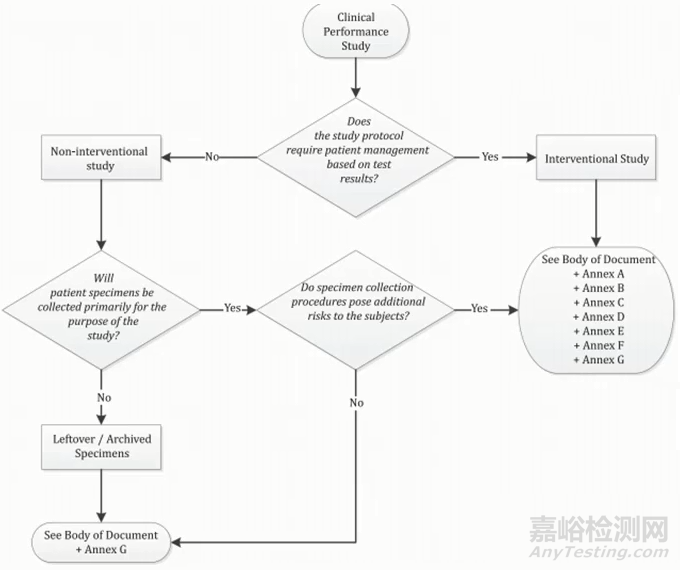
按照这张图的指引去看标准,去理解标准的内容就会比较高效。这张图中有三个关键问题:
问题一: Does the study protocol require patient management based>研究方案是否需要根据测试结果进行患者管理?)
问题二: Will patient specimens be collected primarily for the purpose of the study? (是否涉及到从患者身上获取样本?)
问题三: Do specimen collection procedures pose additional risks to the subjects? (从患者身上获取样本是否存在额外的风险?)

来源:启升资讯


