您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-11 09:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
信达和罗氏达成战略合作。信达生物与罗氏拟联合开发和商业化多个双特异性抗体和细胞治疗产品,用于血液肿瘤和实体肿瘤治疗。根据协议,信达将为其使用罗氏技术开发2:1双特异性T细胞抗体 (TCB) 和通用型CAR-T平台而支付首付款、开发和商业化里程碑付款以及产品销售提成。信达将负责产品的研发、生产和商业化。罗氏对每个产品在中国以外地区的开发和商业化权益保留回购选择权。
国内药讯
1.石四药盐酸右美托咪定申报上市。石家庄四药3类仿制药盐酸右美托咪定注射液上市申请获CDE受理。该产品是精神安定药的重磅品种,2019年在中国公立医疗机构终端销售额接近36亿元。目前该产品通过一致性评价的企业仅有扬子江1家,在第一轮国家带量采购中,扬子江独家中标“4+7”及联盟地区,2019年销售额暴涨181倍。据米内网数据,目前有正大天晴等5家的3类仿制上市申请正在审评审批中,恒瑞、恩华等7家的一致性评价补充申请也在审评审批中。
2.罗氏risdiplam在华上市申请拟纳入优先审评。罗氏口服SMN2基因剪接调节剂risdiplam上市申请获CDE纳入拟优先审评公示名单。在美国,FDA已授予risdiplam孤儿药资格和快速通道资格,有望于今年第三季度获FDA批准,成为全球第三款用于治疗脊髓性肌萎缩症(SMA)的药物。据悉,risdiplam可用于治疗所有类型的SMA患者。目前,risdiplam正在中国开展一项Ⅱ期国际多中心临床试验,评价risdiplam在经基因诊断为SMA但尚未出现症状婴儿中的安全与有效性。
3.天演药业创新抗CTLA-4抗体申报临床。天演药业抗CTLA-4抗体ADG116的临床申请获CDE受理。这是该抗肿瘤新药首次在中国申报临床,也是天演药业继CD137靶向药ADG106和PD-L1抗体之后在中国提交临床申请的第三款创新候选药。据悉,ADG116已在美国获批开展一项在患有晚期/转移性实体瘤的受试者中进行的首次人体(FIH)、开放标签的Ⅰ期剂量递增研究。
4.信达生物1类新药IBI362启动临床。信达生物在研GLP-1R/GCGR双重激动剂注射用IBI362(OXM3)启动一项用于超重或肥胖者减重的临床试验。该研究拟在36例患者中评估IBI362多次皮下注射的安全性、耐受性,确定其临床使用的剂量范围,以及评估IBI362多次皮下注射药代/药效动力学(PK/PD)参数。OXM3是礼来开发的一种长效分子,在早期临床试验中,已显示出有效的控制血糖及减轻受试者体重方面的作用,体现了其在治疗糖尿病、肥胖及非酒精性脂肪性肝炎(NASH)方面的潜在疗效。
5.依生生物研发出皮卡重组蛋白新冠病毒疫苗。依生生物宣布成功研发出皮卡重组蛋白新冠病毒疫苗YS-SC2-010。YS-SC2-010采用重组新型冠状病毒蛋白与皮卡佐剂联合制备而成,目前已完成部分临床前研究。据悉,该在研疫苗具有抗原用量少、抗体产生早,并能诱导机体产生细胞免疫,促使机体获得更早、更强免疫保护的特点。该产品的生产工艺依靠重组蛋白基因工程技术,具有快速实现大规模安全生产的优势。
国际药讯
1.首个佐剂四价流感疫苗获欧盟批准。澳大利亚生物医药CSL集团旗下公司Seqirus宣布,欧盟委员会(EC)已批准第一个佐剂四价流感疫苗Fluad Quadrivalent(aQIV,流感疫苗,佐剂)在整个欧洲上市,用于保护65岁及以上老年人群免受4种季节性流感病毒株的侵袭,包括2个A型流感病毒株和2个B型流感病毒株。在美国,Fluad Quadrivalent已于今年2月获得批准,是美国获批的首个佐剂四价流感疫苗。
2.武田Takhzyro预充式注射器在欧盟即将批准。欧洲药品管理局人用医药产品委员会推荐批准武田的Takhzyro(lanadelumab)预充式注射器上市,Takhzyro是一种皮下注射处方药,已被批准用于12岁及以上患者常规预防遗传性血管水肿(HAE)的复发。目前,Takhzyro以小瓶装300mg注射液提供。预充式注射器是下一代完全组装的产品,比目前的小瓶装相比需要的准备步骤更少,同时也可减少供应和浪费。
3.罕见病基因疗法Ⅰ/Ⅱ期临床结果积极。Sarepta Therapeutics使用AAVrh74载体递送编码全长β-肌聚糖的转基因的基因疗法SRP-9003,在治疗2E型肢带型肌营养不良症(LGMD2E)的Ⅰ/Ⅱ期临床中获积极结果。低剂量SRP-9003治疗组患者一年里运动功能获得持续改善,NSAD评分平均提高约6分(患者疾病自然历史这一评分通常会下降)。高剂量治疗组患者肌肉中β-肌聚糖水平出现剂量依赖性升高,表达β-肌聚糖的阳性肌纤维数目达到总数的72%,且表达部位正确;患者肌酸激酶(生物标志物)水平与基线相比降低89%。
4.阿斯利康BTK抑制剂COVID-19项目取得新进展。阿斯利康(AstraZeneca)新一代BTK抑制剂Calquence(acalabrutinib)联合最佳支持治疗(BSC),在伴发细胞因子风暴的COVID-19重症患者中获积极结果。在10-14天的疗程中,Calquence能够在1~3天内改善患者的氧合作用,使炎症指标C反应蛋白和IL-6迅速恢复正常,淋巴细胞减少症也与氧合改善有关。补充氧气队列中患者出院率达72.7%(8/11),机械通气队列中50%(4/8)患者成功拔管。这项CALAVI研究成果已发表在《科学免疫学》上。
5.Keytruda/化疗组合膀胱癌III期临床失败。近日默沙东(MSD)宣布III期临床KEYNOTE-361(NCT02853305)的试验结果。该研究旨在评估Keytruda联合化疗一线治疗晚期或转移性尿路上皮癌(UC)的疗效,结果显示,与单独化疗相比,Keytruda联合化疗组的总生存期和无进展生存期指标均得到改善,但不具统计学意义。目前该研究的单药治疗组的疗效比较尚未统计分析,KEYNOTE-361研究的完整结果将于医学会议上公布。
6.灵北调整研发战略拟裁员160人。6月9日,灵北(Lundbeck)发布“重新聚焦并振兴研发”计划公告称,计划对其研究与开发(R&D)组织进行变更及优化,以增强公司在神经科学领域中加强和推进各个阶段产品线的能力,并可能导致裁员约130-160人,岗位集中在其研发中心。其中丹麦总部的研发中心将减少约100个职位,其余人员可能来自美国的研发中心。据悉,该计划是灵北“扩展和投资增长战略”的基础。
医药热点
1.葛均波院士团队完成我国首例TAVR瓣膜衰败再TAVR手术。6月4日上午,由葛均波院士、周达新教授治疗团队实施第二次经导管主动脉瓣置换(TAVR)心脏手术的85岁的林老伯顺利出院。该病例是我国首例TAVR瓣膜衰败患者再次TAVR手术的病例,它的成功为目前接受TAVR患者远期瓣膜衰败问题的解决提供良好借鉴。据悉TAVR技术是由葛均波院士于2010年从国外引进中国,用于治疗重度主动脉瓣狭窄患者。林老伯10年前因主动脉瓣重度狭窄植入CoreValve 26mm瓣膜,是我国首例TAVR患者。
2.意大利贝加莫市居民新冠抗体检测57%呈阳性。意大利北部贝加莫市的卫生部门日前称,4月23日到6月3日之间,在进行血液检查的9965名贝加莫省居民中,有57%的居民新冠抗体呈阳性。而在接受检测的10404名卫生工作人员中,只有略高于30%发现具有抗体。贝加莫是意大利新冠疫情最为严重的城市。根据意大利国家统计局的数据,在3月疫情高峰期,贝加莫市的死亡人数比2015-2019年的平均值高出568%。
3.河北将高血压糖尿病用药纳入门诊保障。河北省医保局、卫健委联合印发《关于做好2020年高血压糖尿病门诊用药保障工作的通知》,将采取6项措施,确保2020年底前符合认定条件患者全面纳入门诊用药保障范围。两病用药政策落实将纳入医保基金支付考核。将两病门诊用药待遇享受人次、门诊用药使用情况作为基层医疗机构提供实际医疗服务数量和质量的重要依据,据实拨付医保基金。
4.二级以上公立医院绩效考核开启。6月9日,国家卫健委发出通知,要求采集二级和三级公立医院2019年度绩效考核数据。这意味着全国第二次三级公立医院绩效考核以及全国首次二级公立医院绩效考核拉开大幕。与去年绩效考核操作手册相比,今年新增加了1个指标,即重点监控高值医用耗材收入占比,考核年度医院重点监控高值医用耗材收入占同期耗材总收入比例。三级公立医院绩效考核指标体系延续去年,包括医疗质量、运营效率、持续发展、满意度评价4个方面共55个指标。
股市资讯
【赛升药业】公司的“注射用血管生成抑肽”获得医学伦理委员会审查批件。
【九洲药业】对190名激励对象所持有的未达到解锁条件的235.44万股限制性股票进行回购注销。
【特宝生物】(1)以自有资金分期支付方式向中国肝炎防治基金会捐赠2,000万元,用于支持由中国肝炎防治基金会发起的“中国降低乙肝患者肝癌发生率研究(绿洲)工程项目”。(2)董事李一奎申请辞去公司董事职务,将不再担任公司任何职务;提名李佳鸿为公司第七届董事会非独立董事候选人。
审评动向
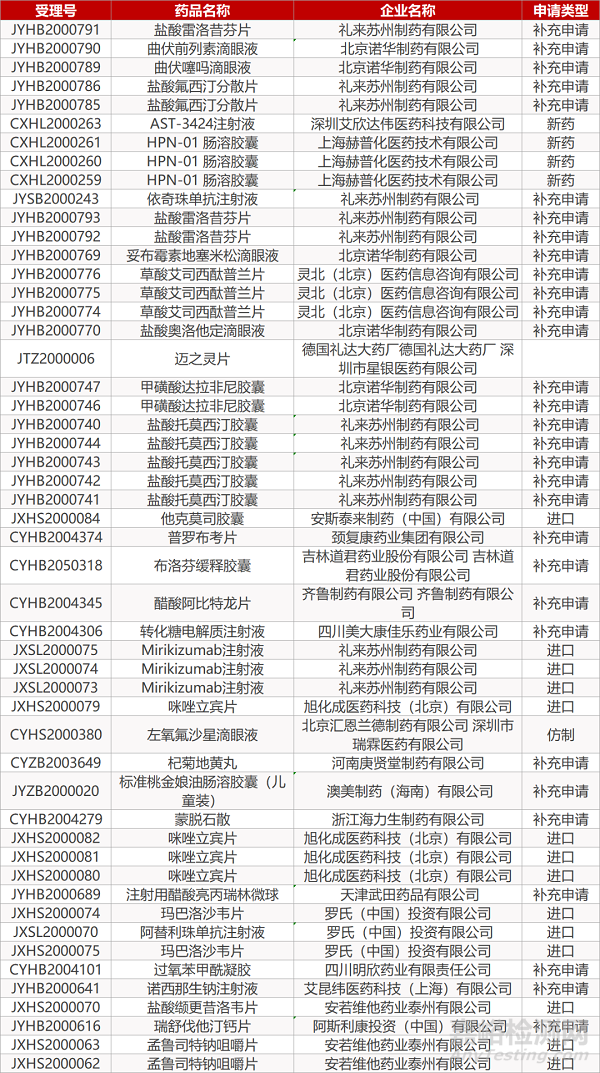
1. CDE最新受理情况(06月10日)
- The End -

来源:药研发


