您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-06 10:05
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
罗氏阿尔茨海默病在研抗体在华申报新临床。罗氏gantenerumab注射液的新临床试验申请获CDE受理。Gantenerumab是一款全人源化单克隆抗体,拟开发用于阿尔茨海默病(AD)的治疗。在全球范围内, gantenerumab已进入Ⅲ期临床开发阶段。在中国,ganteneruma早前已申报过多项临床。目前,罗氏正在开展一项包括中国在内的随机、双盲国际多中心Ⅲ期临床,以评估ganteneruma与安慰剂相比在早期(前驱期至轻度)AD患者中的疗效和安全性。
国内药讯
1.强生重磅抗癌药在华提交两项新上市申请。强生旗下杨森达雷妥尤单抗注射液(daratumumab injection)在中国提交的两项新适应症上市申请获CDE受理。去年7月,该药在中国通过有条件批准上市,用于单药治疗复发和难治性多发性骨髓瘤(MM)成年患者。达雷妥尤单抗是全球及中国首个获批的CD38靶向单抗,已多次获FDA批准扩展治疗MM患者的适用范围。2019年该产品销售额近30亿美元。据悉,该产品在中国登记了7项临床研究,适应症涉及鼻型自然杀伤/T细胞淋巴瘤、系统性轻链型淀粉样变性等。
2.罗欣药业抗菌药上市申请获受理。山东罗欣药业克林霉素磷酸酯注射液3类仿制药上市申请获CDE受理。克林霉素磷酸酯注射液由法玛西亚普强公司研发,1972年获FDA批准上市,商品名为Cleocin Phosphate,适用于大多数革兰氏阳性菌以及厌氧菌引起的各种感染性疾病。目前该原研产品尚未在国内上市,国内拥有该品种生产批件的企业共有74家,但尚未有企业通过一致性评价。2019年中国公立医疗机构终端克林霉素注射剂销售额达23.02亿元。
3.信达生物IBI362启动2型糖尿病临床试验。信达生物登记启动IBI362在血糖控制不佳的中国2型糖尿病患者中的Ⅰb/Ⅱ期临床。该研究评估IBI362多次皮下注射用于生活方式干预或二甲双胍控制不佳的2型糖尿病患者的安全性、耐受性,确定其临床使用的安全剂量范围。IBI362(OXM3)是由礼来开发的一款处于临床开发中期的GLP-1/GCGR双受体激动剂,已在早期临床试验中显示出有效的控制血糖及减轻受试者体重方面的作用,体现了其在治疗糖尿病、肥胖及非酒精性脂肪性肝炎(NASH)方面的潜在疗效。
4.再鼎CD20xCD3双特异性抗体在中国申报临床。再鼎医药与再生元(Regeneron )联合申报的REGN1979注射液的5项临床申请获CDE受理。REGN1979是再生元开发的一款CD20xCD3双特异性抗体,已获FDA授予孤儿药资格,用于治疗弥漫性大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)。在全球,REGN1979正在晚期滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤和其它淋巴瘤患者中开展多项临床研究。再鼎医药拥有该双抗在大中华区的开发和独家商业化权益。
5.石药集团first-in-class骨癌新药在中国申报临床。石药集团旗下上海恩乐迈生物提交的1类新药ALMB-0168注射液临床申请获CDE受理。ALMB-0168是石药集团自主研发的、具First-in-Class潜质的一款Cx43靶向单抗药物。临床前体外和体内的动物实验显示ALMB-0168能有效通过激活Cx43蛋白释放抑癌性物质而起到治疗骨癌和癌症骨转移的作用。ALMB-0168用于治疗骨癌的适应症已获得FDA授予的孤儿药资格认定,并已获批在澳大利亚开展骨癌和癌症骨转移的临床试验。
国际药讯
1.全新机制抗HIV药物获FDA批准。FDA批准ViiV Healthcare公司开发的新型抗逆转录病毒药物Rukobia(fostemsavir)上市,适用于曾经尝试过多种HIV药物疗法,并且由于耐药性、不耐受或安全性而未能成功治疗的HIV感染者。在一项临床试验中,既往接受过5种或更多种HIV治疗方案或有获得性免疫缺陷综合征病史的患者经过24周Rukobia加其他抗逆转录病毒药物的治疗后,53%的患者血液中HIV的RNA水平低到被认为检测不到。96周后,60%的患者HIV的RNA水平继续受到抑制。
2.强生卡格列净获欧盟批准治疗糖尿病肾病。强生降糖药Invokana(canagliflozin,卡格列净)在欧盟获批,用于2型糖尿病(T2D)患者治疗糖尿病肾病(DKD),其药物标签中将纳入里程碑CREDENCE试验的重要肾脏预后数据。该结果表明,与安慰剂组相比,Invokana组在主要复合终点方面的风险显著降低30%(p<0.0001)。主要复合终点由终末期肾病(ESRD)、血清肌酐加倍、肾脏或心血管(CV)事件导致死亡组成。在欧洲,Invokana是近20年来首个获批用于T2D患者减缓DKD进展的药物,也是唯一获批可用于治疗T2D患者DKD的SGLT2抑制剂。
3.创新快速起效镇静剂获FDA批准。FDA批准Acacia公司静脉注射苯二氮卓(benzodiazepine)镇静剂Byfavo(remimazolam)上市,用于诱导和维持接受医疗程序(时长30分钟以内)的成人患者在医疗程序过程中的镇静(sedation)。Byfavo的安全性在包含969例患者的3个关键性研究中得到证实,他们接受了结肠镜或支气管镜检查,其中630例患者使用了Byfavo。试验结果表明,最常见的不良事件为血压异常。
4.瑞德西韦获欧盟有条件批准。吉利德宣布,欧盟已批准Veklury(remdesivir,瑞德西韦)有条件上市,用于治疗新冠病毒感染引起的需要补充氧气的新冠肺炎成年和青少年患者。在欧洲的有条件上市许可最初有效期为1年,但在提交和评估其他确证性数据后,可以延长或转换为无条件上市许可。此前,瑞德西韦已获FDA授予的紧急使用授权,以及日本的特殊批准。一项发表在《新英格兰医学杂志》上的Ⅲ期临床结果显示,瑞德西韦显著缩短COVID-19住院成人患者的恢复时间,且有改善死亡风险的潜在获益。
5.赛诺菲/再生元Kevzara治疗新冠肺炎Ⅲ期失败。赛诺菲和再生元联合开展的类风湿性关节炎药物Kevzara治疗新冠肺炎Ⅲ期临床未达到主要终点和次要终点。在需要机械通气的COVID-19重症患者中,与最佳支持治疗方案相比,Kevzara 400mg与最佳支持治疗联合组患者较基线的改善至少1分的患者比例不具统计学意义的差异;两组不良事件发生率分别为80%和77%;严重不良事件包括多器官功能障碍综合征(Kevzara组6%,安慰剂组5%)和低血压(Kevzara组4%,安慰剂组3%)。这项试验目前已宣布停止。
6.Sarepta与Hansa Biopharma达成合作研发协议。致力于罕见病精准疗法的Sarepta公司与Hansa Biopharma公司达成协议,获得独家全球性许可,开发和推广imlifidase作为一种预治疗手段,扩展治疗杜氏肌营养不良症(DMD)和肢带型肌营养不良症(LGMD)的基因疗法的使用范围。Sarepta的在研基因疗法是一款基于AAV载体的基因疗法。Imlifidase是一种抗体裂解酶,它特异性靶向的IgG并抑制IgG介导的免疫应答。在给药后几小时内可清除针对AAV的IgG抗体,让基因疗法的给药和再次给药成为可能。根据协议,Hansa将获1000万美元的前期付款,总额可能高达3.975亿美元的额外开发、监管和销售里程碑付款。
医药热点
1.他汀类药物可降低新冠死亡率。武汉大学人民医院研究团队的一项最新研究显示,新冠肺炎住院患者使用他汀类药物,可降低有创机械通气、进入重症监护病房及急性呼吸窘迫综合征的发生率,降低患者血液炎症因子水平,阻止新冠肺炎轻症向重症进展,将病亡率从9.4%降至5.2%。这篇以武汉大学人民医院中心实验室张晓晶博士为第一作者、李红良教授为通讯作者的研究论文在线发表于国际期刊《细胞·代谢》上。
2.2020版《中国药典》12月30日起正式实施。国家药监局发布2020年版《中华人民共和国药典》,将于2020年12月30日起正式实施。2020年版《中国药典》共收载品种5911种,与2015年版药典5608种相比,增加5.5%。一部中药收载2711种,其中新增117种、修订452种。二部化学药收载2712种,其中新增117种、修订2387种。三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。四部收载通用技术要求361个,其中制剂通则38个、检测方法及其他通则281个、指导原则42个;药用辅料收载335种。
3.发热门诊患者核酸检测4-6小时出结果。国务院联防联控机制综合组发布《关于进一步加快提高医疗机构新冠病毒核酸检测能力的通知》。通知提出,对于发热门诊患者的核酸检测,要在6小时内报告结果,争取缩短至4小时报告;对于普通门急诊、住院患者及陪护人员等人群的核酸检测,原则上要在12小时内报告结果;对于“愿检尽检”人群的核酸检测,一般在24小时内报告结果。各地要统一检测报告单格式,检测机构要通过自助打印、网络查询等多种方式,为受检者出具检测报告。
股市资讯
【丽珠集团】【健康元】丽珠集团与LTS Lohmann Therapie-Systeme AG签署了《授权合作协议》,LTS将授予本公司阿塞那平透皮贴剂若干知识产权下的独家、包含特许权使用费、可转授权的许可权
【贝达药业】(1)非公开发行股票申请获得深圳证券交易所受理(2)控股股东宁凯铭投资、贝成投资及丁列明博士在2020年1月22日至2020年7月2日期间合计持股变动494.6539万股(占公司总股本的1.23%)
【白云山】控股子公司星群药业和分公司何济公药厂、白云山制药总厂、化学制药厂于近日收到广东省药品监督管理局核准签发的关于牛磺酸颗粒等21个药品的《药品再注册批件》
审评动向
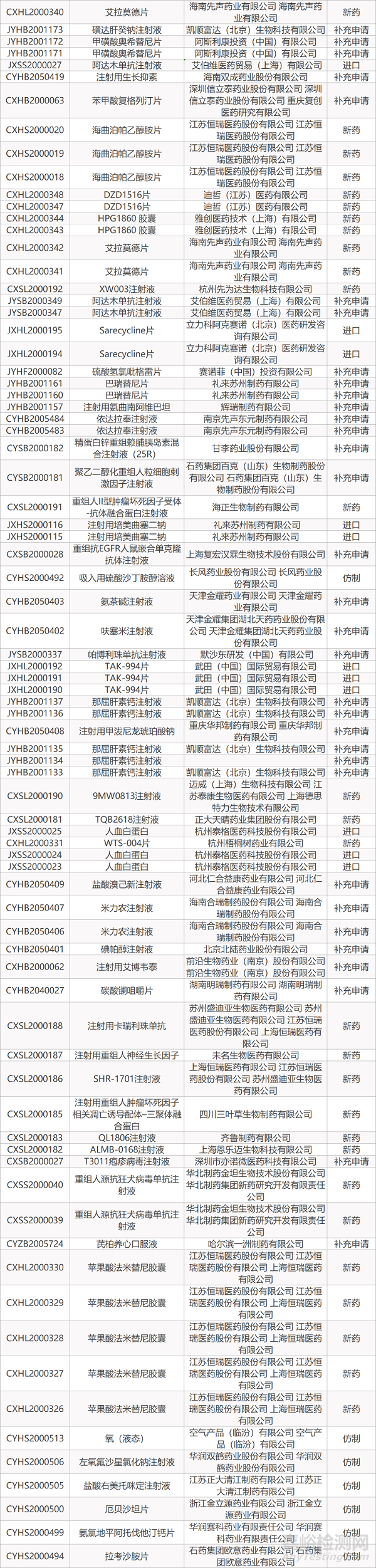
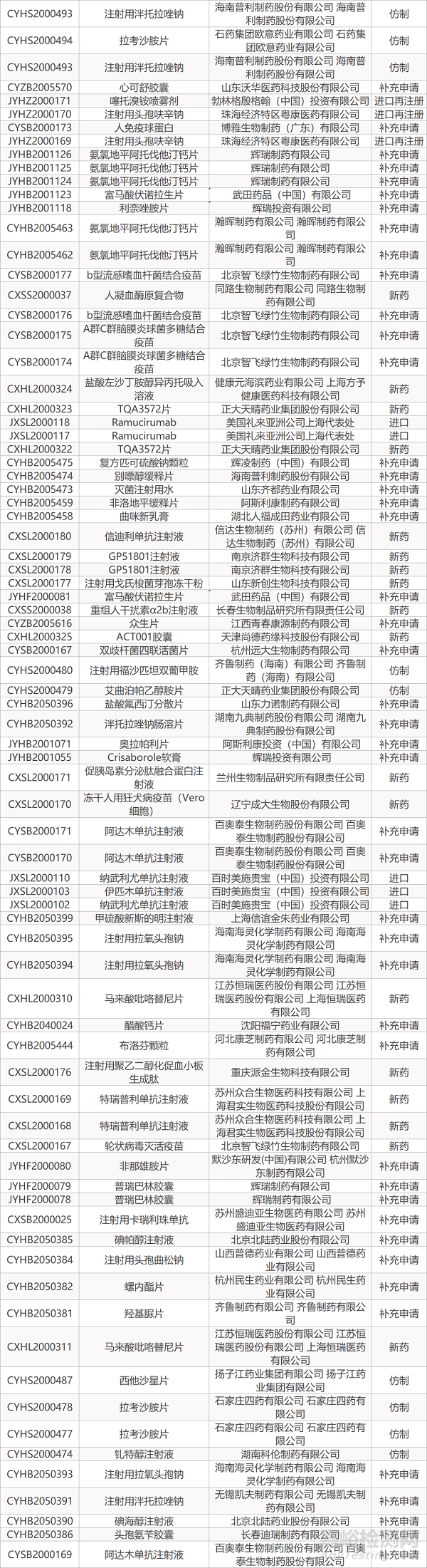
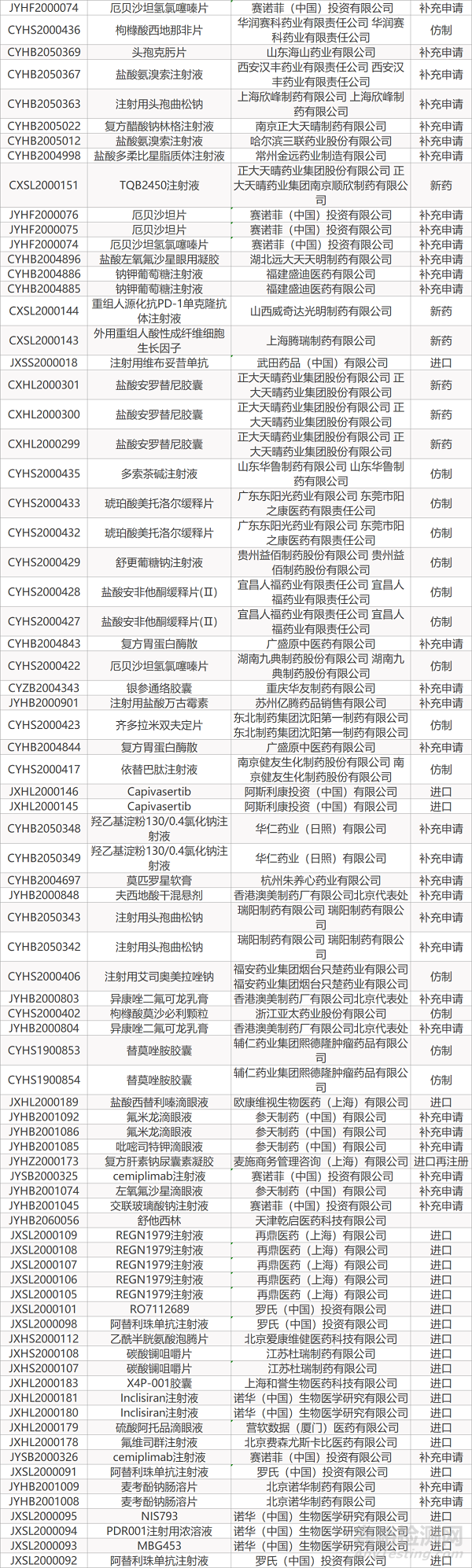
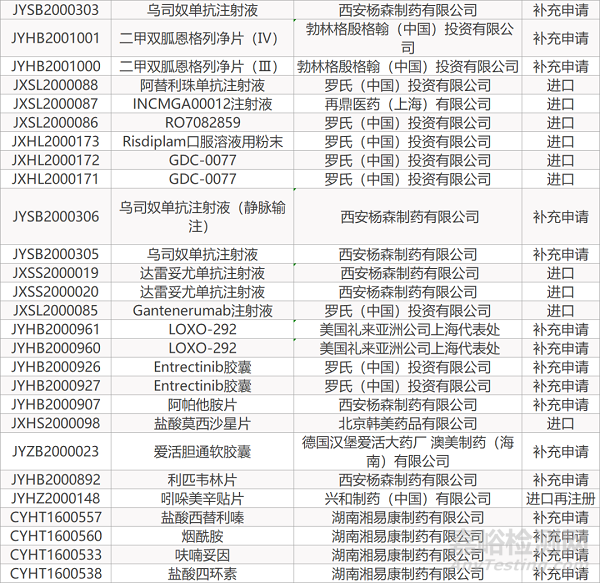
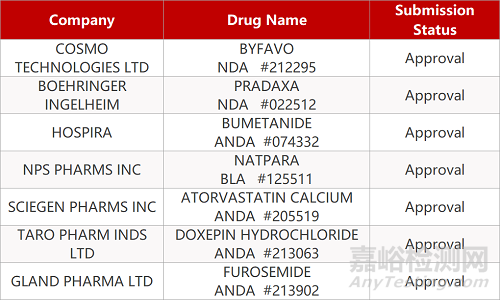
1. CDE最新受理情况(07月05日)
- The End -

来源:药研发


