您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-24 20:49
〔摘 要〕无菌医疗器械在使用前均需要有包装作为无菌屏障进行保存或运输。包装是无菌医疗器械的重要组成部分,其质量直接影响内部医疗器械产品的质量。在无菌植入类医疗器械产品注册时,会要求厂家提供包装验证相关的资料,而合理全面的包装验证资料不仅能够保证产品顺利通过注册,而且可保证医疗器械产品的安全有效性。
医疗器械的安全有效由医疗器械产品及其包装的质量共同决定,因此,一台/套完整的医疗器械是由产品组件和器械包装组成的。国内外均越来越重视医疗器械的包装质量,尤其针对无菌医疗器械的包装,均有完整的标准体系 对其进行检测和验证。那么,如何验证无菌医疗器械包装的符合性,验证包装性能的哪些参数是每一个无菌植入类医疗器械生产企业都要关注的问题。我们只有正确进行包装性能检测,才能够得到可靠有效的验证数据,为医疗器 械产品的注册、生产和使用提供帮助。为此,本研究阐述无菌医疗器械包装验证主要物理性能的检测要点及不合格样品实例,仅供同行及厂家参考。
1 无菌医疗器械包装概述
无菌医疗器械包装包含3个概念:(1)医疗器械 (medical device),GB/T 19633.1-2015[1]中的3.7给出了医疗器械的定义,即在医疗过程中起到辅助作用的器具或试剂;(2)无菌(terminal sterilized),即产品要求无菌使用,此处所指的无菌可以是产品包装后进行灭菌处理,也可以是在无菌条件下进行无菌包装;(3)无菌屏障系统(sterile barrier system,SBS),即防止微生物进入并能够使产品在 使用地点无菌取用的最小包装。本研究讨论的是与无菌医疗器械产品直接接触的最小包装。
常见的无菌医疗器械包装有以下几种形式:(1)预成型的硬塑加盖材,硬塑通常用热成型或压制成型工艺使其预成型,盖材可以是透气材料或不透气材料,典型的方式是将盖材热封于硬塑上,即吸塑盒(图1);(2)易剥离组合袋,典型的结构为一面是膜,另一面是透气材料,如特卫强,这种形式通常称为纸塑袋(图2),一般以预成型的形式供应,除留有1个边开口外,其他3个边均已密封成型;(3)顶头袋(图3),主要由两个不透气的膜面组成,其中1个膜面留有适当距离并热封有透气材料,透气材料可以在最后使用时剥开以便取出医疗器械。

图1 吸塑盒

图2 纸塑袋

图3 顶头袋
无菌医疗器械的安全有效由医疗器械产品本身及其包装的质量共同决定。在医疗器械注册申报资料、某些医疗器械产品注册技术审查指导原则和无源植入性医疗器械货架有效期注册申报资料中,均对包装有相关的要求。
目前,国际上关于无菌医疗器械包装的标准有ISO 11607和EN868系列标准;此外,美国材料与试验协会(ASTM)根据ISO 11607的要求,发布了一系列方法标准。我国对上述国际标准进行了等同转化或根据实际情况进行了修改转化。最常用的标准为GB/T 19633.1《无菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求》、GB/T 19633.2《无菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求》和YY/T 0681系列《无菌医疗器械包装试验方法》、YY/T 0698系列《无菌医疗器械包装材料》,前两个国标是对无菌医疗器械包装的总体要求,后两个系列的行业标准是试验方法。医疗器械生产企业可以依据方法标准验证包装对于GB/T 19633的符合性。
2 无菌医疗器械包装的验证内容
目前,医疗器械相关的法规和文件中未明确规定无菌医疗器械包装验证的项目和指标,生产企业需要根据选用的包装形式和包装材料的特点自行选择验证项目,并对判定指标进行验证。验证时,可以参考原国家食品药品监督 管理总局医疗器械技术审评中心发布的无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)[2],该指导原则中指出无源非植入性医疗器械有关货架有效期注册申报可根据实际情况参照执行;第3部分货架有效期验证内容中提到,包装系统性能检测包括包装完整性、包装强度和微生物屏障性能等检测项目,其中,包装完整性检测项目包括染色液穿透法测定透气包装的密封泄漏试验、目力检测和气泡法测定软性包装泄漏试验等,包装强度测 试项目包括软性屏障材料密封强度试验、无约束包装抗内压破坏试验和模拟运输试验等。此外,指导原则中有提及包装的稳定性和微生物屏障性能。
企业在做无菌医疗器械包装验证时,可以根据需要参考选择上述检测项目,检测标准可参考表1。
表1 无菌医疗器械包装验证项目及参考标准
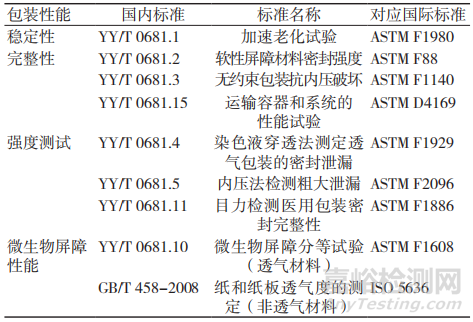
在对无菌医疗器械包装进行验证时,我们建议设立多个检测时间点(一般不少于3个)进行检测,可采用零点时间的性能数据作为检测项目的参照指标,验证的批次推荐采用连续三批,如此得到的验证数据更加可靠,且更具代表性。
3 验证中主要物理性能检测的要点和不合格实例
本研究讨论的是无菌医疗器械包装验证中的主要物理性能,未涉及微生物屏障检测的相关内容;此外,运输试验是对产品单个运输包装的检测,也不在本研究的讨论范围之内。除运输试验外,无菌医疗器械包装验证试验用到的包装中可以添加医疗器械产品,也可以不添加。
3.1 加速老化试验[3]
实际老化程序是验证产品有效期,为包装材料和包装完整性不随时间而降解提供了最佳数据,是产品研发阶段必须进行的研究,但用时较长。加速老化试验为实现缩短研发时间,加快注册资料提交,使新产品在短期内投放市 场提供了可能。为确保加速老化试验真实反映实际老化的结果,实际老化的研究必须与加速老化同步进行,实际老化的时间必须进行至产品的货架寿命。如果加速老化数据没有问题,但是实际老化数据有问题,则需要申请注册变更。
材料在退化中所包含的化学反应遵循阿列纽斯反应速率函数,这一函数表述了相同过程温度每增加或降低10 ℃,大约会使其化学反应的速率加倍或减半(Q10),因此,可以借助加速老化试验进行有效期的验证。
加速老化中有以下几个参数:(1)Q10,温湿度增减10 ℃对应的老化因子,老化因子的保守值取2;(2)TAA,加速老化温度,其选择与材料的性质有关,一般不超过60 ℃;(3)TRT,环境温度,即样品在实际老化时储存的温度,一般为室温25 ℃;(4)AAF,加速老化因子,由公式1计算得到;(5)RTY,预期的老化时间,即样品的预期有效期;(6)AAT,加速老化时间,即样品需要放在老化箱中的时间,由公式2计算得到。

对于RTY推荐选取两个点进行试验,一个点是产品的预计保存期,另一个点一般选择预计保存期减去1年。其目的是防止产品在预计的保存期结束后不能通过性能测试,造成试验失败,多加一个测试点,可以确保加速老化得到 对实时老化有参考价值的数据。
举例:某医疗器械产品的预期有效期为5年,则加速老化的RTY选取5年和4年两个点进行试验;Q10取保守值2,TAA选择60 ℃,TRT取室温25 ℃,计算加速老化时间AAT;将已知 的数据代入(1)(2)中,
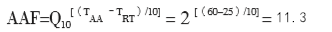 ;
;
老化4年
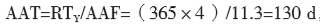
老化5年
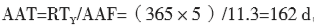 。
。
加速老化试验是在加温条件下进行的,对于湿度敏感的材料要进行湿度控制。这些条件对包装本身具有一定的挑战,会在加速老化后发生材料断裂(图4)、封口张开(图5)等情况,此时需要与实时老化的数据进行比较,再确定产品的 有效期限。
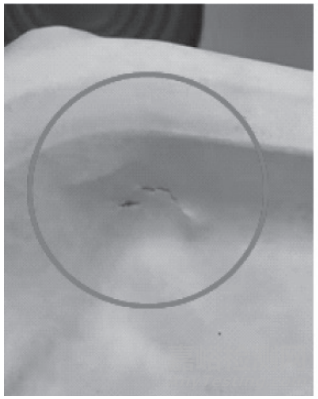
图4 材料发生断裂

图5 包装封口处张开
3.2 密封强度[4]
包装密封强度测试的第1步,确定对包装4个边中的哪个边进行测试。虽然标准中未规定选择的方法,但通常应选择企业自封的边进行测试,如果包装形式是组合袋或顶头袋的卷材,可以只验证自封的1个边,其他3个卷材预 封边可以在进货检验时进行测试;如果包装形式是吸塑盒,则4个边均应进行测试。
包装密封强度测试的第2步,裁样,即将包装封口裁切成宽度为15 mm或25 mm的长方形样品,裁切位置应该在测试边上随机选取,尽量覆盖密封边的各个部位。
包装密封强度测试的第3步,用拉力机测试长度为15 mm或25 mm包装的封口强度,结果用N/15 cm或N/25 cm表示。标准YY/T 0681.2软性屏障材料的密封强度检测是开放型的标准,只规定了检测的方法,并未给出判定的标准,需要企业自己验证适合自己产品的判定标准,密封强度的值过小或过大均不宜,过小,容易在使用前发生包装封口张开,破坏无菌屏障;过大,容易造成开启时材料掉屑,污染包装内的产品(图6)。
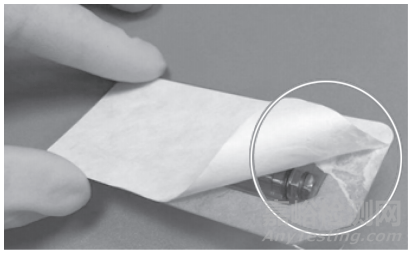
图6 密封强度过大情况实例
3.3 无约束包装抗内压破坏[5]
无约束包装抗内压破坏检测是测试包装在内压发生变化后是否能够保持包装完整性的能力,包含胀破、蠕变和蠕变至胀破3个试验,均是为了评价包装在受到压差变化时是否能够保持完整性。
需要经过航空运输的医疗器械产品,均需要做无约束包装抗内压破坏的测试,真空包装可以免除此项。
对带有透气材料的包装进行无约束包装抗内压破坏测试时,应在试验前先将透气材料一面进行屏障封堵,封堵的方法包含标签或胶带粘贴和在透气材料上涂抹非固体封堵剂。一般实验室会选择用胶带粘贴透气材料的方式,粘 贴时应注意包装的边缘不能有胶带折叠覆盖,否则会影响密封的破裂(图7)。

图7 透气材料胶带封堵方式实例
3.4 染色液穿透法测定透气包装的密封泄漏[6]
染色液穿透法是测试包装封口是否严密的最直观的方法,即利用染色液的穿透性检验包装封口是否有漏点。顶头袋两种材料拼接的部位和信封式密封包装的中间接缝处容易发生密封泄漏(图8)。

图8 染色法密封泄漏不合格样品实例
3.5 内压法检测粗大泄漏(气泡法)[7]
内压法检测粗大泄漏是将测试的包装置于水槽液面下合适的位置,向包装内充气,当达到已知250 μm缺陷处开始有气泡排出的压力时,保持一定的时间,检测包装上是否存在破损的方法。
当被测包装中至少有一面是透气材料时,透气材料在一定的压力下会有气泡从包装内部排出,检测中一定要注意压力的控制,以免产生误判。压力过大时,透气材料产生的气泡是几乎覆盖所有透气材料的均匀气泡,此时仅表示压力过大而并不是产生了漏点,如果在一定压力下某一点有连续的气泡产生则判定为包装有破损。
3.6 目力检测[8]
目力检测是检验员的目力从距离产品30~45 cm处进行密封检验,检验内容包括包装的整个密封区域的完整性和一致性。
密封区域可能出现的缺陷:(1)窄封区(图9)容易在产品储存和运输过程中发生破损,影响包装内产品的无菌状态;过封区(图10)容易影响包装的打开,导致使用不便。
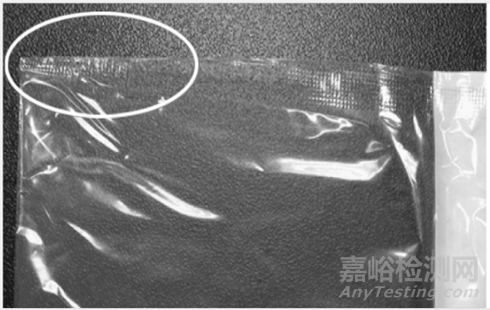
图9 窄封区样品实例
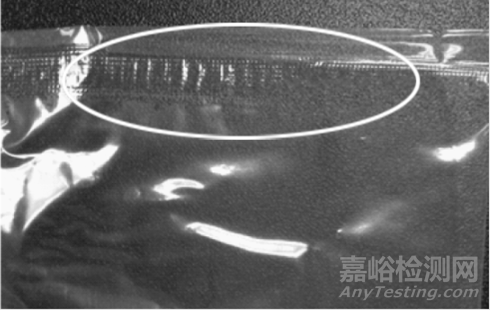
图10 过封区样品实例
总之,无菌医疗器械包装是保障无菌医疗器械产品安全有效的重要组成部分。包装材料的选择和包装形式的确定需要在研发阶段根据产品的特性、生物相容性及灭菌方式等进行确认。对选定后包装的验证内容除了上述主要物理性能外,根据实际需要还可进行软包装材料上印刷墨迹和涂层化学阻抗评价,涂胶层重量、软性屏障膜抗揉搓性能、软性屏障和复合膜抗慢速戳穿性能等检测,以及包装的运输试验和微生物屏障性能评价,以保证包装可以为无菌医疗器械提供良好的无菌屏障至产品使用前的最后一刻。
【参考文献】
[1]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 19633.1-2015 最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求[S/OL].[2015-12-10]. http://www.csres.com/detail/278248.html.
[2]国家食品药品监督管理总局.无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版()2017年第75号)[S/OL].[2017-05-26].
http://news.hexun.com/2017-05-26/189373650.html.
[3]国家药品监督管理局.YY/T 0681.1-2018 无菌医疗器械包装试验方法 第1部分:加速老化试验指南 [S/OL].[2018-12-20].
http://www.csres.com/detail/323110.html.
[4]国家食品药品监督管理局.YY/T 0681.2-2010 无菌医疗器械包装试验方法 第2部分:软性屏障材料的密封强度[S/OL].[201012-27].
http://www.csres.com/detail/217749.html.
[5]国家食品药品监督管理局.YY/T 0681.3-2010 无菌医疗器械包装试验方法 第3部分:无约束包装抗内压破坏[S/OL].[201012-27].
http://www.csres.com/detail/217750.html.
[6]国家食品药品监督管理局.YY/T 0681.4-2010 无菌医疗器械包装试验方法 第4部分:染色液穿透法测定透气包装的密封泄漏[S/OL].[2010-12-27].
http://www.csres.com/detail/217751.html.
[7]国家食品药品监督管理局.YY/T 0681.5-2010 无菌医疗器械包装试验方法 第5部分:内压法检测粗大泄漏(气泡法)[S/OL].[2010-12-27].
http://www.csres.com/detail/217752.html.
[8]国家食品药品监督管理总局.YY/T 0681.11-2014 无菌医疗器械包装试验方法 第11部分:目力检测医用包装密封完整性 [S/OL].[2014-06-17].
http://www.csres.com/detail/243806.html.

来源: 医疗装备杂志


