您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-27 10:02
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.齐鲁制药培唑帕尼片首仿即将获批。8月24日,齐鲁制药提交的新4类仿制药培唑帕尼片上市申请进入“在审批”阶段,有望近期获批成为该药物的国内首仿。培唑帕尼是一款多靶点酪氨酸激酶抑制剂,由葛兰素史克原研开发,于2009年10月获得FDA批准,目前已获批的适应症有肾细胞癌和软组织肉瘤。原研产品目前的持证商为诺华。2017年2月,诺华培唑帕尼用于治疗肾细胞癌在中国获批。2019年原研培唑帕尼销售额约7.55亿美元。
2.石药盐酸米托蒽醌脂质体注射液申报上市。石药集团2.2类新药盐酸米托蒽醌脂质体注射液(10ml: 10mg)上市申请获CDE受理,用于既往至少接受过一次一线标准治疗的复发/难治性外周T细胞淋巴瘤患者。此次申请主要基于一项盐酸米托蒽醌脂质体注射液在复发/难治性外周T细胞和NK/T细胞淋巴瘤中的单臂、开放、多中心的II期研究结果。目前,全球尚无该产品同类产品获批上市。
3.荣昌生物HER2抗体偶联药物拟纳入优先审评。荣昌生物注射用纬迪西妥单抗上市申请获CDE纳入拟优先审评公示名单。纬迪西妥单抗(Disitamab vedotin,RC48,爱地希)是一款抗HER2抗体药物偶联物(ADC),已在国内开展多项注册性临床试验,适应症涉及胃癌、尿路上皮癌、HER2低表达的乳腺癌,此次申请上市的适应症预测为胃癌。一项在ASCO2020年会上公布的II期临床结果显示,RC48在晚期/转移性胃癌患者中经IRC评估的ORR达23.6%,中位PFS为4.1个月,中位OS为7.5个月。
4.康缘药业痛风新药获临床批件。康缘药业WXSH0493片获国家药监局两项临床试验默示许可,拟开发用于痛风的治疗。痛风和高尿酸血症已逐渐成为一类严重的代谢类疾病,目前这类患者的一线用药主要包括别嘌呤醇、非布司他、丙磺舒、苯溴马隆、秋水仙碱和URAT1抑制剂lesinurad等。WXSH0493是一款新型URAT1抑制剂,是根据lesinurad在临床应用中暴露出的问题而针对性设计的,旨在提高lesinurad在临床用药中的有效性和安全性。
5.罗氏TIGIT单抗在中国获批临床。8月25日,罗氏TIGIT单抗Tiragolumab注射液获国家药监局一项临床试验默示许可,与阿替利珠单抗联合治疗不可切除的局部晚期复发性或转移性食管鳞癌。TIGIT是肿瘤免疫治疗中最有前景和潜力的靶点之一。抗TIGIT抗体单药疗法或与抗PD-1/PD-L1抗体联合用药均展现出一定的安全性和抗肿瘤有效性。目前,国外有多个抗TIGIT单抗相关的临床研究正在开展,但尚无品种获批上市。
6.宜明昂科完成Pre-B+轮融资。8月25日,宜明昂科宣布完成7000万元Pre-B+轮融资,本次融资由共青城瑞吉三期独家投资。本次融资将主要用于其CD47靶向融合蛋白药物IMM01、以及CD47xCD20双抗IMM0306的临床试验研究。目前,IMM01正在中国开展一项针对复发/难治性淋巴瘤的Ⅰ期临床;IMM0306正在一项Ⅰ期临床中用于治疗难治/复发性CD20阳性B细胞非霍奇金淋巴瘤患者,以评估单次及多次给药的安全性、耐受性以及药代动力学特征。
国际药讯
1.罗氏靶向抗癌药Kadcyla新适应症在日本获批。日本厚生劳动省批准罗氏旗下中外制药的HER2靶向药物Kadcyla(trastuzumab emtansine)用于接受新辅助(术前)治疗后存在残留浸润性疾病的HER2阳性早期乳腺癌(eBC)患者的辅助(术后)治疗。在美国和欧盟,Kadcyla分别于2019年5月和12月获批上述适应症。Kadcyla此前已获批用于治疗不可切除性或复发性HER2阳性乳腺癌患者,此次最新批准,为接受新辅助(术前)治疗不能获得病理学完全缓解的HER2阳性eBC患者提供一种改善预后的术后新治疗方案。
2.Tesetaxel治疗转移性乳腺癌达Ⅲ期研究终点。Odonate Therapeutics在研口服紫杉烷类化疗药物Tesetaxel用于治疗转移性乳腺癌的Ⅲ期临床CONTESSA获积极结果。与卡培他滨标准剂量组相比,tesetaxel联合卡培他滨减少剂量方案显著提高患者的无进展生存期(平均PFS:9.8个月vs6.9个月)。有≥5%的患者发生3级及以上治疗突发不良事件,包括中性粒细胞减少(联合组71.2%,单药组8.3%)等。目前OS数据尚未成熟,但最近的一项中期分析表明,tesetaxel联合卡培他滨对OS没有不良影响,研究的最终分析预计在2022年进行。
3.武田Soticlestat治疗儿童难治性癫痫临床试验成功。武田与Ovid Therapeutics联合开发的CH24H抑制剂soticlestat,在治疗儿童难治性癫痫发作伴Dravet综合征(DS,抽搐性发作)或Lennox-Gastaut综合征(LGS,跌倒发作)的Ⅱ期临床ELEKTRA中达到主要终点。soticlestat在12周的维持期内将患者抽搐发作和跌倒发作的频率的中位数降低了27.8%,而安慰剂组这一数值增加了3.1%(安慰剂组数据调整后的中位数平均降低了30.5%;p=0.0007)。在整个20周治疗期,soticlestat将患者的抽搐发作和跌倒发作频率的中位数降低了29.8%,而安慰剂组这一数值变化为0.0%。临床中无新的安全信号出现。
4.DMD创新疗法获FDA优先审评资格。FDA受理Sarepta公司寻求加速批准casimersen(SRP-4045)的新药申请,并授予其优先审评资格,预计2021年2月25日之前做出回复。Casimersen是一种磷酸二酰胺吗啉寡聚物(PMO),用于治疗适于使用外显子45跳跃治疗的杜氏肌营养不良(DMD)患者。在一项Ⅲ期临床ESSENCE中,与基线和安慰剂相比,casimersen使这类患者肌肉中的抗肌萎缩蛋白产量出现统计学显著性增加。
5.默克MET抑制剂获FDA优先审评资格。FDA受理默克旗下EMD Serono公司口服MET抑制剂tepotinib的新药申请(NDA),并授予其优先审评资格。适应症为治疗存在MET外显子14(METex14)跳跃突变的转移性非小细胞肺癌(NSCLC)成人患者。在一项关键性Ⅱ期临床VISION中,包括脑转移患者和通过液体活检(LBx)和组织活检(TBx)评估的患者在内,不同治疗线的缓解率和持久抗肿瘤活性一致。经IRC评估的患者总缓解率达46%,患者的中位缓解持续时间为11.1个月。
医药热点
1.北京新冠肺炎疫情在院病例全部清零。8月25日,北京地坛医院在院治疗的1例大连市疫情关联病例和1例境外输入病例,经医护人员精心疗护,各方专业力量通力合作,治愈出院,北京新冠肺炎在院确诊病例全部清零。8月25日0时至24时,北京市无新增报告本地确诊病例、疑似病例和无症状感染者;无新增报告境外输入确诊病例、疑似病例和无症状感染者。
2.干预措施可降低七成新冠感染。国际期刊《自然》刊登了华中科技大学公共卫生学院团队的最新研究成果,这一研究是在前期总结武汉市公共卫生干预措施与疫情流行趋势关联性的论文基础上,进一步通过数学模型评估了防控效果,揭示了新冠病毒的传播特征。研究人员对武汉市截至3月8日的疫情流行曲线进行拟合及参数估计,通过模型比较,研究估计武汉采取的集中隔离“四类人”等系列干预措施降低了69.6%的感染。
3.普通门诊统筹拟覆盖全体参保职工。国家医保局就《关于建立健全职工基本医疗保险门诊共济保障机制的指导意见》向社会公开征求意见。《意见》提出,建立完善普通门诊医疗费用统筹保障机制,从高血压、糖尿病等群众负担较重的门诊慢性病入手,逐步将多发病、常见病的普通门诊医疗费纳入统筹基金支付范围。普通门诊统筹覆盖全体职工医保参保人员,支付比例从50%起步。
股市资讯
【振德医疗】收到国家知识产权局颁发的关于一种治疗烧伤的防粘连医用抗菌纱布的制备方法的专利证书。
【九强生物】收到国家药监局颁发的关于癌胚抗原测定试剂盒(胶乳免疫比浊法) 、前列腺特异性抗原校准品、前列腺特异性抗原质控品的《医疗器械注册证》。
【复星医药】控股子公司上海复星医药产业发展有限公司收到上海药监局颁发的美洛昔康片的《药品生产许可证》。
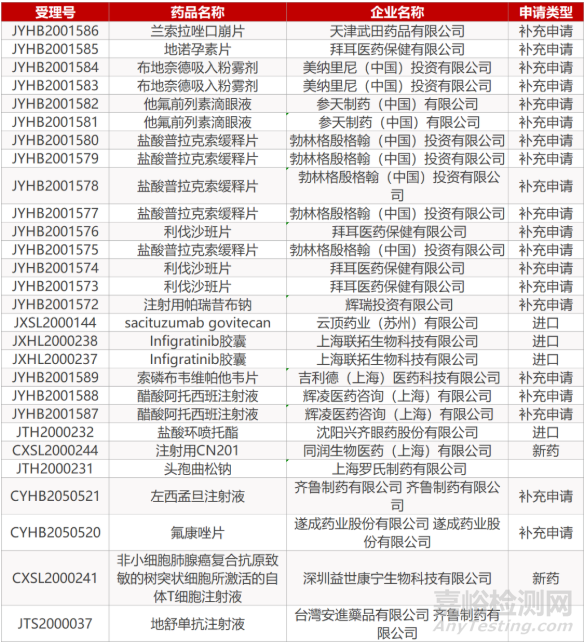
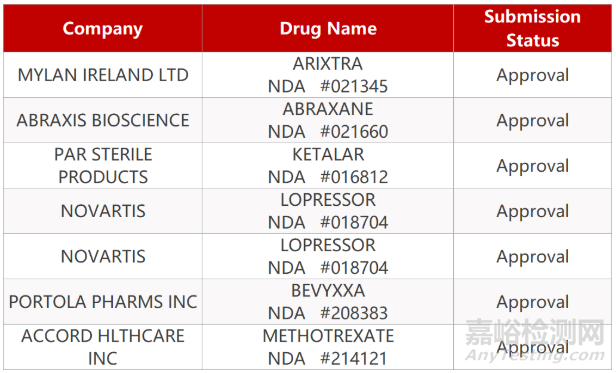
审评动向
- The End -

来源:药研发


