您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-14 18:58
随着人口老龄化趋势的加剧,以髋关节为代表的老年退变性骨关节病的发病率日益增高。人工全髋关节置换术因具有可恢复关节稳定性、改善关节功能、缓解疼痛等优点,引起了广大骨科医师和患者的广泛关注。近年来,以髋关节脱位为代表的并发症和日趋年轻化的关节置换,增加了人工全髋关节翻修的可能性[1]。髋关节翻修的主要原因包括假体无菌性松动、位置不良和严重的聚乙烯内衬磨损等引起的髋臼假体失败等。由于个体差异无法被排除,需要更 具有个体适宜性的关节设计,从而尽量避免使用损耗的增加,减少翻修的需要。近年来,3D 打印技术(又被称作增材制造)的出现为个性化髋关节设计及出现严重髋臼骨缺损关节的特异性翻修带来了新的希望[2]。其是一种新兴的快速成型方法,作为第三次产业技术革命的代表,根据断层扫描或计算机辅助设计软件形成数据,并进行立体化建模,对逐层铺展的粉末状的金属或塑料等可黏合材料进行扫描固化,最终打印出个性化的三维实物模型[3-5]。
传统的金属加工工艺以减材或等材模具铸造为主,不能实现致密体与多孔结构之间的良好配合,难以模拟复杂的真实骨组织结构。电子束熔融(electron beam melting, EBM)技术是当前在髋关节置换中常用的3D打印技术,通过高真空逐层电子束熔融金属粉末来制造零件,可制备出能够模拟自然骨组织中的松质骨与皮质骨,且具有良好生物相容性的金属多孔结构人工假体。目前,国内外对多孔金属的研究主要集中于多孔钛和多孔钽。有报道指出,多孔金属臼杯能够促进新骨形成,生物性能及缺损骨面与臼杯贴附良好,进而保证髋臼的初始安全稳定性[6-10],早期临床效果显著[11-13]。骨-假体界面的摩擦系数和间隙是骨与假体有效整合的决定因素,因此,具有高摩擦系数、高孔隙率和更好力学性质的3D打印金属多孔结构人工假体,备受广大临床研究者的关注。3D打印钛金属植入物与骨组织 表面获得骨性融合的关键在于早期新骨形成[14]。目前,骨整合研究集中于羊和犬等大型动物体内[15-17]及兔等小型动物股骨髁、桡骨和股骨中的新骨形成情况[18-21]。除了良好的骨整合性能外,要保证3D打印钛金属材料符合植入器械的标准,必须验证其与组织器官的反应处于可接受的水平,不应出现人体异物排斥、过敏、严重炎症等不利反应[22]; 而3D打印本身的特点决定了除力学性能外,在颗粒残留、离子析出等方面其可能存在与常规加工的材料完全不同的性质。因此,这些领域的生物学相关评价成了决定类似器械研发及上市可能性的重点。目前,3D打印钛金属材料的离子析出研究主要集中于体外细胞毒实验,涉及金属离子的析出 是否影响细胞黏附及增殖[23-24],而探讨其在体内血液和器官的析出过程的研究较少。因此,为了更好地认识3D打印骨小梁髋关节假体较传统器械在生物体反应上的变化,为类似3D打印器械的临床前评价提供思路与实例,本研究对其骨整合性能、局部组织反应及与体内钛、铝、钒离子释放相关的风险进行了分析,以探求其安全性、有效性证据,并为进行特征性生物相容性评价的方案设计提供线索。
1 材料与方法
1.1 材料
1.1.1 实验动物
成年日本大耳白兔49只,雄性24只,雌性25只(未产并无孕),由四川省实验动物专委会养殖场提供,使用许可证编号:SCXK(川)-2013-14,体重1.7~2.4 kg。本次由四川医疗器械生物材料和制品检验中心实验动物管理和使用委员会对实验程序进行审核,确保符合实验动物福利伦理要求;实验动物设施及管理符合GB/T 16886.22011《医疗器械生物学评价 第2部分:动物福利要求》;此外,对室温及室内湿度进行日常监控,将室温控制在20~23 ℃,相对湿度控制在44%~52%,采用人工控制12 h光照、12 h黑暗。
1.1.2 主要试剂及仪器
钛(Ti)标准溶液(国家钢铁材料测试中心钢铁研究总院,1 000 μg/ml,GSB G 62014-90);铝(Al)标准溶液(国家钢铁材料测试中心钢铁研究总院,1000 μg/ml, GSBG 62006-90);钒(V)标准溶液(国家钢铁材料测试中心钢铁研究总院,1000 μg/ml,GSBG 62016-90);醇溶性伊红染液、组织染色分化液、组织染色蓝化液 (Thermo SCIENTIFIC,美国);电感耦合等离子体发射光谱仪(ICP-OES Optima 8000 Perkin Elmer,美国);EXAKT 300 CP/400 CS硬组织切磨系统(EXKT Apparatebau GmbH & Co.KG,德国);BX60奥林巴斯显微镜、DP22显微镜成像系统(Olympus Corporation公司,日本)。
1.2 方法
1.2.1 动物分组
将实验动物随机分为实验组(骨小梁髋关节假体材料)20只、对照组(纯钛基材)20只和假手术组9只,对每只实验动物两侧股骨作相同处理,并按照时间点分为12周和26周(植入术后12周实验组和对照组各8只,假手术组4只;植入术后26周实验组和对照组各12只,假手术组5只)。
1.2.2 骨缺损制备及植入手术
采用40 mg/kg 2%戊巴比妥钠(德国默克公司,批号:20160412)行耳缘静脉注射麻醉;切开双侧股骨外侧,于股骨干钻孔,制成直径2.5 mm、深6.0 mm 的孔道,在股骨两侧均植入骨小梁髋关节假体材料试样(直径2.5 mm、长 8 mm的圆柱试棒,实验组)、纯钛基材(与实验组试样形状相同,对照组),假手术组不植入任何材料;逐层缝合,肌内注射庆大霉素(西南药业股份有限公司,国药准字 H50021450)3 d。
1.2.3 大体观察
肉眼观察术后各时间点孔口处新生骨的覆盖情况及是否存在股骨断裂、脓肿、出血或其他异常情况。
1.2.4 组织学观察
于植入术后12、26周,分别处死动物,将取得的股骨标本,经固定、脱水、渗透、包埋、硬组织切片及苏木素伊红染色处理,在光学显微镜下观察新生骨组织形成和植入材料周围成骨情况,采用GB/T 16886.6-2015《医疗器械生物学评价 第6部分:植入后局部反应试验》中半定量评价系统评价局部组织生物学反应。
1.2.5 金属离子(钛、铝、钒)测试
分别取植入术前动物外周血和植入术后动物(外周血、肝、肾、植入位点附近的肌肉)组织1 g,置于聚四氟乙烯管中,加入4 ml硝酸、1 ml过氧化氢,加热消解样品,待样品消解完全,加热蒸发到2 ml,冷却至室温定容到10 ml容量瓶即得到样品溶液;与此同时,制备空白溶液;然后,采用ICP-OES预热30 min,按照浓度由低到高的顺序测定标准系列溶液,经计算机自动绘制标准工作曲线;之后采用空白校准,检测各个组织样品溶液中钛、铝、钒的含量。
1.3 统计学描述及处理
(1)本研究中的描述性数据,如切片上某观察指标相关率的描述,以观察阳性结果数/总观察切片数进行处理。(2)本研究中获得的定量数据,如各组各离子的析出量等,采用SPSS 2.3统计软件进行处理,定量资料统计描述以x±s表示,各组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2结果
2.1 大体观察
植入术后12、26周,实验组与对照组材料与周围骨组织结合良好,植入后孔口处可见大量新生骨覆盖、未见股骨断裂,植入位点处未见脓肿、出血或其他异常。
2.2 组织学观察
植入术后12周,实验组与对照组,孔口处(图1a,d), 骨缺损区域大量新生骨形成,部分区域新生骨与植入材料结合紧密,比率分别为100.0%和37.5%,新生骨内已见成熟的哈佛氏系统;植入材料区域无明显的骨溶解和骨吸收;材料附近可见少量成纤维细胞,偶见淋巴细胞,比率分别为62.5% 和59.3%。髓腔内(图1b,e),材料附近可见少量新生骨小梁,比率分别为40.2% 和71.8%;新生骨小梁与材料紧密结合率分别为18.7% 和43.7%。部分材料附近(图1c,f),可见少量成纤维细胞,偶见淋巴细胞、新血管形成,比率分别为87.5% 和90.6%。
植入术后12周,假手术组,孔口处(图1g),靠近髓腔一侧可见少量新生骨未完全构建成骨组织;外侧孔口处已被一些新生骨覆盖,内侧孔口处未见新生骨覆盖,比率为25.0%;外侧孔口和内侧孔口处均已被新生骨覆盖,中间孔口处未见新生骨覆盖,比率为8.3%。髓腔内(图1h,i),仅见极少量的新血管形成。
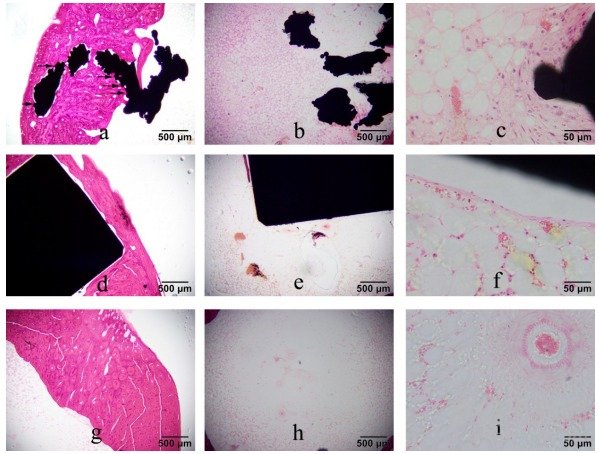
注:a为实验组孔口处,“→”表示材料与新生骨紧密结合;b为实验组髓腔内;c为实验组髓腔内材料/组织界面处;d为对照组孔口处;e为对照组髓腔内;f为对照组髓腔内材料/组织界面处;g为假手术组孔口处;h和i均为假手术组髓腔内
图1 植入术后12周3组硬组织切片的HE染色结果
植入术后26周,实验组与对照组,孔口处(图2a,d),骨缺损区域大量新生骨形成,部分新生骨与材料结合紧密,比率分别为100.0%和38.6%;植入材料区域无明显的骨溶解和骨吸收;与术后12周比较,实验组骨构建更成熟;骨缺损部位新生骨成板层状结构,与周围骨组织基本相同;对照组的骨构建程度与术后12周相似;实验组与对照组植入材料附近均可见少量成纤维细胞,偶见淋巴细胞,比率分别为44.6%和47.7%,低于术后12周。髓腔内(图2b,e),部分材料附近可见新生骨小梁,比率分别为55.2%和79.9%,与术后12周比较,实验组和对照组均增多;新生骨小梁与材料紧密结合率分别为49.0%和29.5%,与术后12周比较,实验组增高,对照组降低。局部材料附近(图2c,f),可见少量成纤维细胞,偶见淋巴细胞和新血管形成,比率分 别为82.9% 和86.3%,与术后12周比较,略有降低。
植入术后26周,假手术组,孔口处(图2g),靠近髓腔一侧见极少量新生骨未完全构建成骨组织,比率为 50.0%,骨构建程度高于术后12周;外侧孔口已被一些新生骨覆盖,内侧孔口未见新生骨覆盖,比率为15.0%;内侧 孔口处已被一些新生骨覆盖,外侧孔口处未见新生骨覆盖,比率为10.0%;内外两侧孔口均被新生骨覆盖,中间孔口处未见新生骨覆盖,比率为10.0%,骨构建与术后12周相似。髓腔内(图2h,i),仅见极少量的新血管形成。
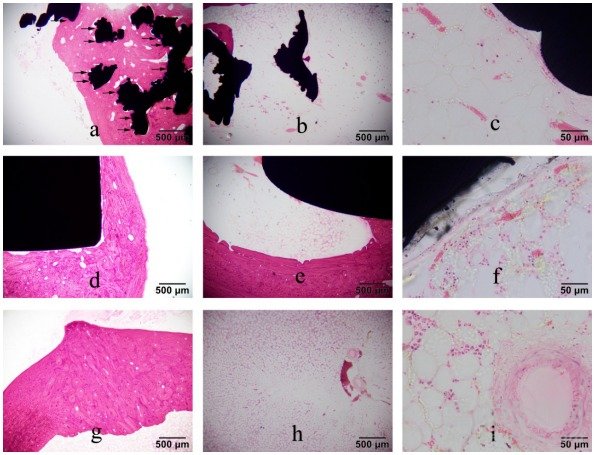
注:a为实验组孔口处,“→”表示材料与新生骨紧密结合;b为实验组髓腔内;c为实验组髓腔内材料/组织界面处;d为对照组孔口处;e为对照组髓腔内;f为对照组髓腔内材料/组织界面处;g为假手术组孔口处;h和i均为假手术组髓腔内
图2 植入术后26周3组硬组织切片的HE染色结果
2.3 金属离子析出分析结果
2.3.1 3组外周血中金属离子的析出量比较
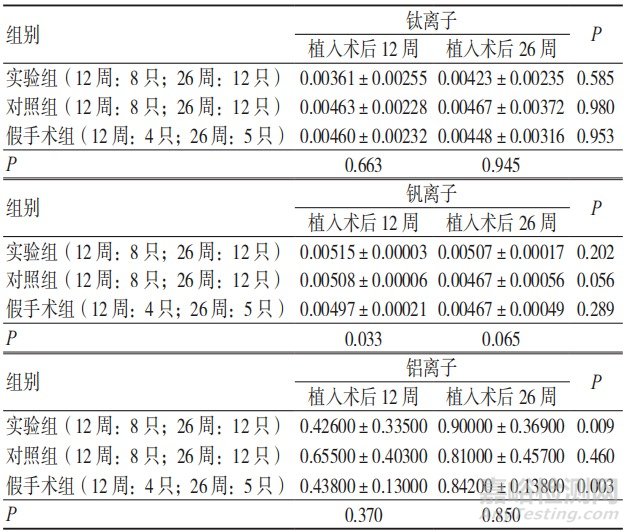
植入术后12周,3组外周血中钛和铝离子的析出量比较,差异无统计学意义(P>0.05),钒离子的析出量比较,差异有统计学意义(P<0.05),但考虑到钒离子在外周血中未检出,该项结果由检出限算出,只和称样量有关,无意义;植入术后26周,3组外周血中钛、铝、钒离子的析出量比较,差异无 统计学意义(P>0.05);植入术后26周,实验组、假手术组外周血中钛和钒离子的析出量与术后12周比较,差异无统计学意义(P>0.05),铝离子的析出量与术后12周比较,差异有统 计学意义(P<0.05);与植入术后12周比较,术后26周实验组铝离子的析出量增加约1倍;实验组植入术后12周铝离子 的析出量明显低于同时期对照组,术后26周铝离子的析出量与对照组相近,实验组和对照组铝离子的毒性差异较小;植入术后26周,对照组外周血中钛、铝、钒离子的析出量与术后12周比较,差异无统计学意义(P>0.05),见表1。
表1 3组植入术后各阶段外周血中钛、铝、钒离子的析出量比较(μg/g,x±s)
2.3.2 3组肝脏中金属离子的析出量比较
植入术后12、26周,3组肝脏中钛、铝、钒离子的析出量比较,差异无统计学意义(P>0.05);植入术后26周,3组肝脏中钛、铝、钒离子的析出量与术后12周比较,差异无统计学意义(P>0.05),见表2。
2.3.3 3组肾脏中金属离子的析出量比较
植入术后12、26周,3组肾脏中钛、铝、钒离子的析出量比较,差异无统计学意义(P>0.05);植入术后26周,实验组肾脏中钛和钒离子的析出量与术后12周比较,差异无统计学意义(P>0.05),铝离子的析出量低于术后12周,差异有统计学意义(P<0.05);植入术后26周,对照组肾脏中钛离子的析出量高于术后12周,钒离子的析出量低于术后12周,差异有统计学意义(P<0.05),铝离子的析出量与术后12周比较,差异无统计学意义(P>0.05);植入术后26周,假手术组肾脏中钛、铝、钒离子的析出量与术后12周比较,差异无统计学意义(P>0.05),见表3。
表2 3组植入术后各阶段肝脏中钛、铝、钒离子的析出量比较(μg/g,x±s)
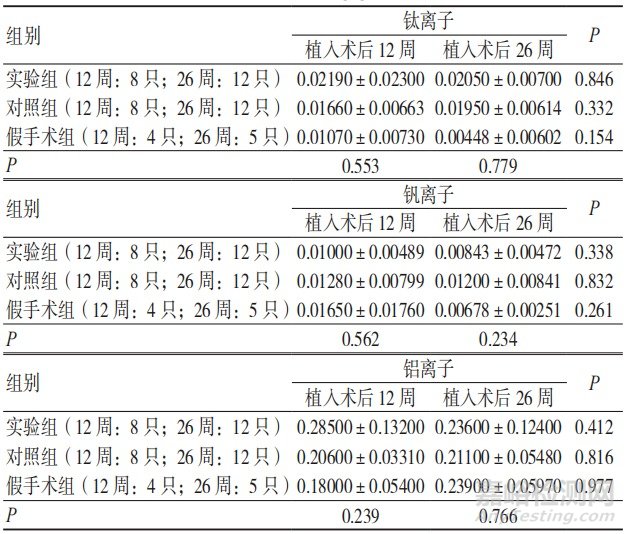
表3 3组植入术后各阶段肾脏中钛、铝、钒离子的析出量比较(μg/g,x±s)
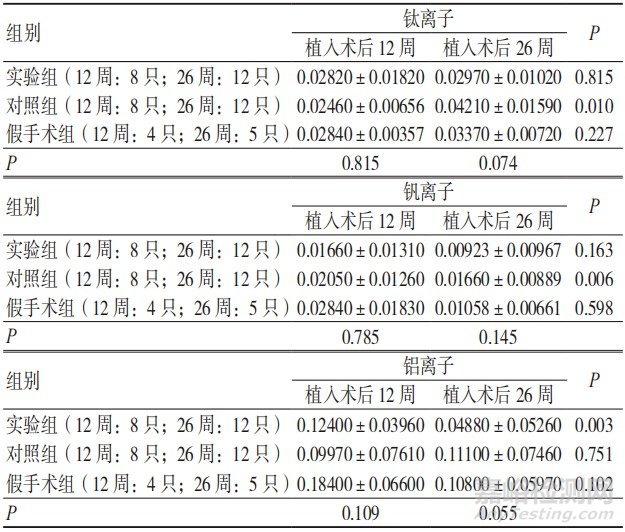
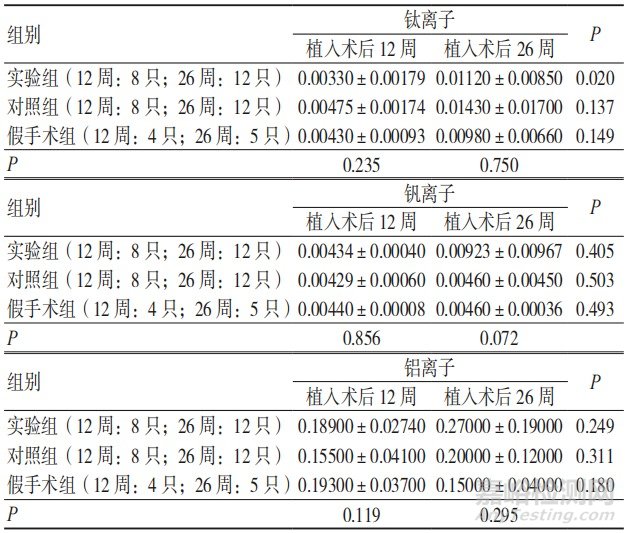
2.3.4 3组植入位点周围肌肉中金属离子的析出量比较
植入术后12、26周,3组植入位点周围肌肉中钛、铝、钒离子的析出量比较,差异无统计学意义(P>0.05);植入术后26周,实验组植入位点周围肌肉中钛离子的析出量与术后12周比较,差异有统计学意义(P<0.05),钒离子 和铝离子的析出量与术后12周比较,差异无统计学意义(P>0.05);植入术后26周,对照组和假手术组植入位点周围肌肉中钛、铝、钒离子的析出量与术后12周比较,差异无统计学意义(P>0.05),见表4。
表4 3组植入术后各阶段植入位点周围肌肉中钛、铝、钒离子的析出量比较(μg/g,x±s)
3讨论
近年来,髋关节疾病患者数量不断增加且呈年轻化趋势。为了更好地满足患者的个体需求,我们对关节加工工艺提出了新的要求;且由于术后活动量增加,患者可能出现活动障碍、髋关节疼痛、髋臼滑落和骨缺损情况,致使翻 修术数量不断上升,翻修难度加大,术后并发症发生风险增加,因此,安全、高效且更高患者个体适应度的假体成了骨科医师追求的热点[25]。随着科学的发展和制造技术的进步,传统的自体骨、异体骨和人工骨移植可能会逐渐被以 3D打印多孔钛为代表的新型人工植入物所取代。钛金属及其合金因具有生物相容性良好、机械性能优异、价格低廉且耐腐蚀性等优点,已成为生物医学材料应用中很好的选择[26]。传统工艺制成的钛合金产品虽然能够起到长期的骨 整合效果,在一定程度上满足了临床需求,但在长期使用过程中会引起植入体周围炎症、骨吸收或无菌性松动等现象[27]。与传统工艺制成的致密钛合金材料比较,3D打印多孔钛合金材料具有更多的优势,如被认为对组织和人体细 胞无毒害及过敏反应、多孔结构有利于新骨形成、优良的骨整合性能能够促进骨组织和材料的结合、具有与正常骨质接近的力学性质(如杨氏模量等)、可增强植入体远期支撑作用等[28],但是,作为与传统加工方式明显不同的新的 工艺,尤其是对于高风险的医疗器械,其本身特点带来的风险必须慎重考虑。
虽然理化性质的检测分析能够给出器械使用性能的基本信息,但由于生物体具有复杂性,动物体内实验不能被忽视。动物实验能够提供体外实验无法模拟的生理载荷和体内环境,更好地证实其安全性和有效性,而检验检测方法的发展与成熟为在动物实验中合并理化分析提供了可能性,从而提供更丰富的评价基础信息。目前,以家兔为代表的小型动物由于价格经济、来源广泛和手术操作相对简单,而在骨缺损模型建立、骨修复能力和新骨形成等骨科实验中应用较多。对多孔钽在兔股骨内进行的研究发现,其能够促进新骨形成,有利于骨结合及改建[29-30]。鉴于体内实验能够更准确地反映植入物与骨结合能力的真实状态,本研究通过成年日本大耳白兔股骨植入来探讨两组材料的骨整合作用,并设立了假手术组,结果显示,硬组织切片经苏木素-伊红染色后可以看出,各植入物周围均有新骨形成,未见骨吸收、组织坏死或其他异常情况。本研究中,对照组即纯钛与骨的结合形成方式主要为周边骨组织逐渐向植入物生长形成新骨(距离成骨),其中偶尔可见纤维,与以往的研究结果相似[31];实验组新骨形成和结合均优于对照组,髋关节假体材料周边几乎全为成熟骨组织,钙化程度增高,孔隙内骨组织已充满,植入物与骨界面呈无缝式的骨结合,仅偶见轻微缝隙,与穆亚星[32]、Wang等[33]和李冬梅等[34]的研究结果相似;假手术组骨构建程度不及植入物组,可见3D打印植入物的骨整合功能优于动物本身愈合成骨。
以Ti6Al4V合金为代表的钛合金作为3D打印金属材料被广泛应用于医疗领域中,用于制备人工髋关节、骨板、骨钉 等植入体等[35]。以钛元素为主的钛合金中主要添加α和β两类相对稳定的合金元素,其中α稳定元素中,铝使用最广泛[36],但铝离子可能引起神经紊乱和贫血等不良症状;钒为β相对 稳定元素及钛合金主要的添加元素,但有报道显示钒元素对生物体内肾、肝、骨、脾等器官具有毒性作用[37]。本研究对钛、铝、钒在动物体内的析出行为进行了分析,结果显示,3种金属离子在3组体内的析出比较无显著差异,各 离子析出均为微克级,远低于犬骨髓基质干细胞培养液中钛、铝、钒的金属离子浓度[38],证实了3D打印 Ti6Al4V几乎不会影响周边细胞黏附及增殖,提示其具有良好的生物相容性;对离子析出量的分析提示,主要以铝的析出为主, 钛和钒的析出量相近且较少,远低于相同植入周期植入表面经大颗粒喷砂酸蚀处理的种植体在动物外周血中的钛离子析出量,说明3D打印金属材料能够避免植入后钛离子的局部聚集,且钛离子浓度随着时间延长而增加[39];而本研究中植入后外周血中铝离子浓度随着时间延长逐渐升高,与植入不含铍的镍铬合金全冠戴用后外周血中的铝离子析出结果的报道相似[40]。本研究中,铝离子析出总量顺序为血液>肌肉>肝脏>肾脏,不同时期,实验组铝离子在肝脏中析出相对稳定,而在植入术后26周的肾脏中铝离子含量低于术后12周,表明随着时间的推移,铝离子在肾脏中的含量逐渐降低,可能是铝离子在逐渐被代谢排出。总之,铝离子的变化强烈提示了3D打印金属在选择基材时应对铝离子加以关注,动物体内铝离子的存在是否可导致进一步的毒理病理变化,有待进一步分析。
【参考文献】
[1]Seagrave KG, Troelsen A, Malchau H, et al.Acetabular cup position and risk of dislocation in primary total hip arthroplasty[J]. Acta Orthopaedica, 2017, 88(1):10-17.
[2]郭宇,冯德宏,王凌,等.3D 打印技术在髋关节置换中的应用及价值[J].中国组织工程研究,2020,24(12):1962-1968.
[3]Yao R, Xu G, Mao SS, et al.Three-dimensional printing: review of application in medicine and hepatic surgery[J]. Cancer Biology & Medicine, 2016, 75: 443-451.
[4]甄珍,王健,奚廷斐,等.3D打印钛金属骨科植入物应用现状[J].中国生物医学工程学报,2019,38(2):240-251.
[5]Bruns N, Krettek C. 3D-printing in trauma surgery: Planning, printing and processing[J]. Der Unfallchirurg, 2019, 122(4): 270-277.
[6]Evola FR, Costarella L, Evola G, et al. Acetabular revisions using porous tantalum components: A retrospective study with 5-10 years follow-up[J]. World J Orthop, 2017, 8(7): 553-560.
[7]Brüggemann A, Fredlund E, Mallmin H, et al. Are porous tantalum cups superior to conventional reinforcement rings?[J]. Acta Orthopaedica, 2017, 88(1): 35-40.
[8]Concina C, Crucil M, Fabbro S, et al. Porous Tantalum Acetabular Cups and Augments in Revision Total Hip Arthroplasty: Clinical and Radiological Evaluation at Mid-term Follow-up. BIT's 4th Annual World Congress of Orthopaedics-2017[C]. The 19th Scientific Annual Congress of Shanxi Orthopaedic Association, Italy, 2017.
[9]付君,倪明,陈继营,等.个性化3D 打印多孔钛合金加强块重建重度髋臼骨缺损的早期临床疗效研究 [J].中华骨与关节外科 杂志,2018,11(6):402-407.
[10]王涛,任伟平,张志强 .钽金属大杯重建严重髋臼骨缺损的早期临床疗效观察[J].中华关节外科杂志(电子版),2018,12(4): 561-566.
[11]董汉青,徐耀增,耿得春,等.骨小梁金属髋臼杯在全髋关节置换术中的应用及近期疗效[J].中国骨与关节损伤杂志, 2016,31(6):571-573.
[12]黄德勇,张亮,蒋毅,等.钽金属骨小梁臼杯结合同种异体骨植骨治疗髋关节翻修术中严重骨缺损[J].中国矫形外科杂志, 2016,34(12):1057-1061. [13]黄勇,周一新,郭盛杰,等.钽金属骨小梁臼杯联合钽金属加强块重建髋臼严重骨缺损的临床研究[J].中华关节外科杂志(电子版),2015,9(6):732-739.
[14]刘路坦.3D打印多孔钛金属植入物不同孔隙率对骨长入影响的实验研究[D].蚌埠:蚌埠医学院,2019.
[15]王财儒.多孔钛合金股骨头支撑棒的设计制备及其治疗早期股骨头坏死的实验研究 [D].西安:第四军医大学,2015.
[16]黄海.多孔钛合金表面HA涂层改性及大动物体内骨修复研究[D].西安:第四军医大学,2016.
[17]孙艳征.复合涂层3D打印钛骨仿生牙种植体的生物力学实验及体内实验研究[D].青岛:青岛大学,2018.
[18]邓威,郑欣,谌业帅,等.3D打印多孔钛材料修复兔股骨髁骨缺损的实验研究[J].实验动物与比较医学,2017,37(4):266-272.
[19]全宸良.两种新型多孔骨组织工程支架的制备及性能研究[D].北京:解放军医学院,2017.
[20]章辉.选择性激光熔覆制备多孔钛试件及动物实验研究[D].合肥:安徽医科大学,2017.
[21]毛梦芸.选择性激光烧结制备多孔钛的机械性能与生物相容性研究[D].济南:山东大学,2016.
[22]赵丹妹,王春仁,韩倩倩,等.3D打印医用钛合金植入物的研究现状与进展 [J].中国医疗器械信息,2017,23(3):1-5.
[23]张雷青.基于数字化设计和3D打印的颌骨缺损赝复体修复及3D打印金属材料细胞毒性的初步研究[D].杭州:浙江大学,2016.
[24]董研,彭伟,张雷青,等.基于选择性激光熔融技术的赝复体支架打印及金属试件细胞毒性的研究[C].第十一次全国口腔修复学学术会议论文汇编,2017:55.
[25]夏志勇,马康康,李凯,等.3D打印钛合金骨小梁金属臼杯全髋关节置换术的短期疗效 [J].中国骨与关节损伤杂志,2017,32(2):121-124.
[26]Sidambe AT, Figueroa IA, Hamilton HGC, et al. Metal injection moulding of CP-Ti components for biomedical applications[J]. Journal of Materials Processiong Technology, 2012, 212(7): 1591-1597.
[27]Kirkland NT, Birbilis N,Staiger MP. Assessing the corrosion of biodegradable magnesium implants: a critical review of current methodologies and their limitations[J].Acta Biomater, 2012, 8(3): 925-936.
[28]胡如印.3D打印多孔钛金属骨小梁髋臼杯的临床应用、体内基础研究与生物力学研究[D].南宁:广西医科大学,2018.
[29]赖振权,崔逸爽,陈超,等.新型骨植入材料多孔钽-骨结合界面成骨以及相关成骨因子的表达及意义 [J]. 中国组织工程研 究,2017,21(18):2789-2795.
[30]胡可欣,季平,王涵,等.3D 打印多孔钽种植体对骨整合影响的实验研究 [J].华西口腔医学杂志,2018,36(3):291-295.
[31]梅双.纯钛种植体表面生物矿化构建及对骨结合影响的研究[D].石家庄:河北医科大学,2016.
[32]穆亚星.激光立体成形多孔钛的生物学性能的研究[D].西安:第四军医大学,2014.
[33]Wang GH, Fu H, Zhao YZ, et al.Bone integration properties of antibacterial biomimetic porous titanium implants[J]. Transaction of Nonferrous Metals Society of China, 2017(27): 2007-2014.
[34]李冬梅,刘新晖,李庆星,等.纳米级细胞型组织工程人工骨的构建:修复下颌骨缺损[J].中国组织工程研究,2018,22(14):2146-2151.
[35]李敬.选区激光熔化成型Ti6Al4V及其多孔结构的工艺与性能研究 [D]. 广州:华南理工大学,2018.
[36]孙钰.新型低弹性模量钛合金TiNbZrTaSi生物相容性及骨整合能力实验研究[D].长春:吉林大学,2016.
[37]侯乐干.医用多孔钛基金属材料制备及性能研究[D].哈尔滨:哈尔滨工程大学,2013.
[38]赵冰静.3D打印Ti-6Al-4V理化性能及生物相容性研究[D].北京:中国人民解放军医学院,2016.
[39]杨倩.两种表面处理种植体钛离子释放的体内研究[D].桂林:广西医科大学,2017.
[40]苏俭生.六种牙科铸造合金金属离子析出对机体影响的实验研究[D].上海:同济大学,2006.

来源:医疗装备杂志


