您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-24 09:23
纳米制剂特异性的发现和摧毁人体内的肿瘤细胞,吸引研究人员制备了无数具有独特理化性质(比如粒径,形态和表面性质)的纳米制剂,试图实现多种多样的生物和医疗功能。可以靶向肿瘤部位的纳米制剂,经光照可以发热从而杀死肿瘤细胞的无机纳米制剂,包封各种显影剂的纳米制剂,在特定pH条件或酶催化下才会释放药物的纳米制剂,同时具备诊断和治疗功能的纳米制剂等等。文献表明这些纳米制剂在体外(比如细胞)和体内(比如小鼠模型)上都能发现和杀死肿瘤细胞,但真正应用到临床上的纳米制剂却非常少,这个问题引人深思。
Chan认为问题的关键在于纳米制剂递送到肿瘤部位的效率太低。纳米制剂只有递送到肿瘤的病变细胞或组织达到一定浓度,才能发挥其治疗或者诊断效果。然而纳米制剂一旦被注射进体内,将同时面临物理和生理层面的屏障(比如,扩散、流动和剪切力、聚合、蛋白吸附、吞噬隔离和肾清除),这些因素都会影响纳米制剂到达病变的靶组织或靶细胞。
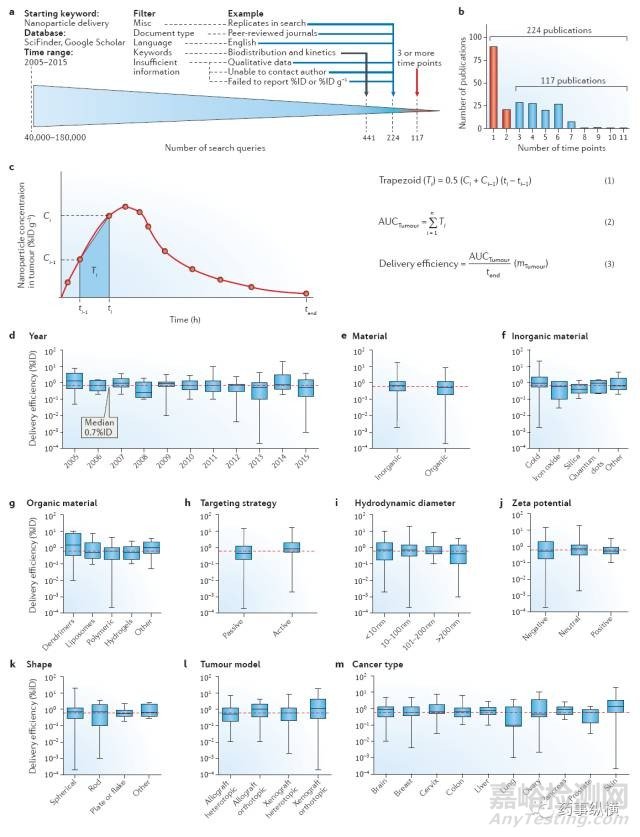
为考察当前纳米制剂递送到固体肿瘤部位的效率,Chan以“纳米制剂递送”为关键词在SciFinder和谷歌学者数据库上进行检索,共确定了224篇文章(图1的a和b)。通过对最近10年发表的文章进行分析,可以了解到当前纳米制剂的研究进展。在这些汇编研究中117篇文章中的数据被汇总在表格中,将这些数据标准化并通过一个“非隔间线性梯形分析模型”来计算纳米制剂的递送效率,“非隔间线性梯形分析模型”经常被用来研究药动学中的药时曲线(AUC),在这里我们用来定量纳米制剂在肿瘤部位的AUC,其中时间和浓度的信息最少有三个点(图1,c),这一要求就将224篇文章中的107篇排除掉了。
更多的时间点能使AUC更精确,但只有很少的研究者会提供3个以上的时间点,Chan经常联系作者以获取更多的信息来计算AUC。分析结果表明注射的纳米制剂只有0.7%(中位数)能够到达肿瘤部位,并且近10年来递送效率没有提高的趋势(图1,d)。这个结果表明假如给老鼠注射1000个纳米粒,那么只有7个纳米粒能够到达老鼠的肿瘤部位。在这里使用中位数而不是算数平均值来表征递送效率结果,是因为计算用的数据变异性很大,中位数能更好的说明真实情况。
从这些数据中可以看出一些趋势(图1,e-m)。首先,无机材料制备的纳米制剂相比有机材料制备的纳米制剂递送效率更高(分别是0.8%和0.6%)。第二,粒径小于100nm的纳米制剂相比粒径大于100nm的纳米制剂递送效率更高(分别是0.7%和0.6%)。第三,中性电荷(-10︿10mv)的纳米制剂相比正电荷纳米制剂(>10mv)和负电荷纳米制剂(<-10mv)的递送效率更高(分别是0.7%,0.6%和0.5%)。第四,主动靶向的纳米制剂递送效率优于被动靶向的纳米制剂(分别是0.9%和0.6%)。第五,棒状纳米制剂相比球形、平板状和薄片状的纳米制剂递送效率更高(分别是1.1%,0.7%,0.6%和0.9%)。最后,相比异位肿瘤模型,原位肿瘤模型的递送效率更高。
只有0.7%的纳米制剂能够到达肿瘤部位,会造成什么样的后果呢?纳米制剂包封药物有两种方法,一种是药物被包封在制剂内部,另一种是药物被包封在制剂表面。假设这两种方法的包封率是一样的,载药量跟纳米粒的半径和体积成正比。假设用纳米制剂(粒径为60nm)包封分子量为500g/mol的抗肿瘤药物,该抗肿瘤药物的IC50(半数抑制浓度)假设是1.0μm,纳米制剂在肿瘤的递送效率假设是1.0%,该纳米制剂的载药量假设为20%,那么为了使药物在小鼠(假设体重20g)肿瘤部位(体积为0.5cm3)浓度达到IC50,需要注射1.2×1012个纳米粒子,或者15.7mg·kg-1。
一般研究在小鼠身上注射药物的量为10mg·kg-1,这个剂量在小鼠身上是可行的。然而如果想在人体身上达到同样的治疗效果,将这个剂量从小鼠放大到人身上,用体表面积计算注射剂量,就需要2.7×1014个纳米粒(药物被包封于纳米制剂内部),19mg·m-2或者6.4×1014个纳米粒(药物被包封于纳米制剂表面),45mg·m-2。假设纳米粒的浓度为5nM,换算成注射剂量就需要90ml(药物被包封于纳米制剂内部)或213ml(药物被包封于纳米制剂表面)的注射体积。
如果我们想将递送效率为1%的纳米制剂应用于临床,需要解决很多难题。首先纳米制剂的放大生产就不是一个简单的事情,用于在小动物(比如小鼠模型)身上进行学术研究的少量纳米制剂,其合成制备是容易的。但大规模合成制备纳米制剂时,纳米制剂的质量和功能可能会受到影响(例如,形成共聚体,粒径范围,粒径性状)。
第二,用于病人常规治疗使用的纳米制剂,因为需要的量非常多,其价格可能会非常昂贵。
第三,纳米制剂需要相对较高的注射量,可能会限制其在临床上的应用。对纳米制剂进行浓缩可能会破坏其胶体稳定性,造成不可逆的聚合,或是缩短其保质期。
另外,因为剩余99%的纳米制剂不能到达肿瘤组织,高剂量的纳米制剂增加了发生毒副作用的风险。最后,用于肿瘤细胞的工程纳米制剂和用于亚细胞靶向的纳米制剂,其剂量和制备费用可能会更高。解决以上问题的关键就是提高纳米制剂的递送效率,假如纳米制剂的递送效率能从1%升高到10%,纳米制剂的注射体积就可以从90ml降低到9ml。
这个结果严重打击了研究者的信心,随后还是在这个杂志McNeil发表文章进行反驳。他认为用在肿瘤部位蓄积纳米制剂的多少来评价纳米制剂是否成功,这种评价方法是不正确的。
McNeil表示,在纳米技术表征实验室他已经对超过150种纳米制剂的临床前药代动力学和毒理学进行过研究。研究结果表明“蓄积在肿瘤部位的纳米制剂”这个参数不能准确反映纳米制剂的临床效果,并且FDA也不认可这个说法。相比chan比较纳米制剂在肿瘤部位蓄积的多少,纳米制剂包载的活性成分(也就是API,药物)才是更合适的评价指标。
传统的药代动力学参数,比如达峰时间(Cmax)、清除率(CL)、消除半衰期(t1/2)和分布体积(Vd),就能够很好的评价纳米制剂中API的治疗效果,比如说API的Cmax就能说明药物浓度是否达到杀死体内肿瘤细胞的剂量。纳米制剂中的API有几种存在形式,被包封在纳米制剂中,游离或与蛋白结合,其中只有游离的API才能杀死肿瘤细胞。而Chan仅评价纳米制剂在肿瘤部位的蓄积量,忽视了很多重要的药代动力学参数。另外,Chan计算纳米制剂递送效率的有些数据也是错误的。纳米药物在肿瘤部位蓄积肯定是重要的,但用经典的药代动力学计算纳米制剂的递送效率是不合适的。

脂质体制剂(Doxil)就是一个很好的例子。虽然肿瘤部位能检测到的Doxil不足1%,但在肿瘤部位的多柔比星浓度已经是普通多柔比星制剂的好几倍。临床上,Doxil在体内的半衰期是普通多柔比星制剂的5倍,清除率则慢了3个数量级,同时毒副作用也降低了很多。Doxil的例子表明纳米制剂能够很好的改善药物的Pk和毒副作用,但目前为止为什么我们还没有看到哪种纳米制剂能够显著提高患者的生存率呢?这是因为现在大部分纳米制剂包载的药物都是没有专利保护的细胞毒类药物(为了减少监管风险),尽管做成了纳米制剂,肿瘤细胞对其包载的API早就有了耐药性。只要纳米制剂中的API还是老药,就别想做成纳米制剂后疗效有多大的提升。据说医药工业正在将有潜力的新药做成纳米制剂,我们可以期待它们在临床2期和3期的表现。
Chan说目前抗肿瘤纳米制剂在临床上没有重大进展,这种说法是不准确的。2016年8月5号我们以“纳米粒或脂质体或胶束”为关键词在Clinicaltrials.gov网站上进行检索,相关研究有500多项,并且其中的25%在3期临床研究阶段。Celator制药公司的CPX-351 (VYXEOS),将阿糖胞苷和柔红霉素制备成复方纳米制剂,患者的平均生存期达到了9.56个月,而对照组生存期最长的仅为5.95个月;与两种传统疗法相比,患者死亡风险下降了31%之多。爵士制药(JAZZ)已经计划用15亿美元收购Celator。
总之,纳米制剂的目标是改善患者的治疗效果。现在的纳米制剂已经能够改善药物Pk,降低药物毒副作用。单纯用纳米制剂递送效率评价纳米制剂是不合适的。
真理越辩越明,继续在这个杂志,Chan回应了McNeil。
McNeil对我们文章提出了批评,他的主要论据是“纳米制剂有超过500项的临床研究,其中25%在3期临床研究阶段”。这些数字第一眼看上去令人印象深刻,似乎纳米制剂在临床医学上已经了取得重大进展。
我们对McNeil以“纳米粒或脂质体或胶束”为关键词在Clinicaltrials.gov的检索结果进行了分析,一共有582项临床研究正在进行。然而让我们惊讶的是其中的339项研究根本没有使用纳米制剂,虽然这399项研究中至少含有“纳米粒或脂质体或胶束”中的一个关键词,出现这种情况我们也不能理解。
真正“纳米粒或脂质体或胶束”的有关临床研究只有243项,其中42项(17%)3期临床研究,3项(1%)4期临床研究,而且3项临床4期研究所治疗的都是液体肿瘤,而不是实体瘤。我们之前所讨论的都是实体瘤,不是液体肿瘤。另外,75%的临床研究中所使用的药物都是FDA 已经批准很多年的了。La-Beck和他的同事做的一项荟萃分析表明14项正在进行临床研究的脂质体制剂,其相比普通制剂虽然在小鼠身上有优势,但在临床上并无优势。McNeil认为纳米制剂临床疗效不好的原因是因为纳米制剂包载的都是老药,纳米制剂包载新药就能发挥很好的效果,但如果是那样的话纳米技术还有什么用?
McNeil说爵士制药(JAZZ)准备用15亿美元收购Celator,证明纳米制剂研究领域的成功。按照他的逻辑,我们可以说这个研究领域已经失败透了,因为失败的故事比成功的故事多太多。2007年Merck用11亿美元收购Sirna Therapeutics,当时市场上还没有siRNA药物,但Merck随后又以1.75亿美元将Sirna Therapeutics卖给Alnylam,损失高达9.25亿美元。财务上的损失并不能说明SiRNA递送就是空中楼阁,因为当时失败的原因有很多可能。当年flagship公司在BIND Therapeutics fail上的失败,打击的不仅是公司,投资者,还有整个领域的研究者。如果Celator(现在是爵士公司)能将它的技术运用于普通病人的治疗,那么整个领域的研究人员都会为它欢呼!因为这样才代表这个领域的成功!而Celator的成功很大程度上是因为它选择的目标疾病(液体肿瘤),纳米制剂设计或其它因素。
McNeil说用Pk来评价纳米制剂是不合适的。我们的调查研究表明很少有研究人员在他们的文章中说明药物的Pk,可能是因为Pk测量的是药物在血浆中的浓度。从纳米制剂的角度来讲,测量药物的Pk是有争议的。比如说,包载在脂质体中的阿霉素不会发挥药效,此时阿霉素的Cmax能说明什么。抗肿瘤纳米制剂研究的重点是纳米制剂,不是药物,因此研究人员关注的是纳米制剂在肿瘤部位的蓄积程度。我们用已发表的数据分析纳米制剂在肿瘤部位的递送效率,为该领域的研究人员提供了一个比较标准。任何研究人员都可以对我们的原始数据重新分析,我们的原始数据在补充材料里有138页。为了评价纳米制剂的临床疗效,必须有一个适当的评价方法,当前并没有一个标准方法,FDA也还未对纳米制剂建立起一个监管框架。
究竟用纳米制剂包载的API还是纳米制剂本身来评价纳米制剂,大佬们的争论暂告一段落。但对于McNeil说用传统的药代动力学参数评价纳米制剂中的API,小编有自己的看法,之前药事纵横上的一篇文章“FDA专家3个案例分享:等效源于设计(EbD)”表明传统的药代动力学参数不能正确评价复杂制剂。另外Doxil的发明人也曾写过一篇文章“Pharmacokinetics, efficacy and toxicity of different pegylated liposomal doxorubicin formulations in preclinical models: is a conventional bioequivalence approach sufficient to ensure therapeutic equivalence of pegylated liposomal doxorubicin products?”,在这片文章里,作者也认为血浆药物浓度不能真实反映纳米制剂的抗肿瘤效果。
纳米制剂的研究任重而道远,还有很多的困难需要我们克服。
参考文章
1. Analysis of nanoparticle delivery to tumours
2. Evaluation of nanomedicines: stick to the basics
3. Reply to ‘‘Evaluation of nanomedicines: stick to the basics’’
4. 药理毒理学部纳米药物安全性评价专题讨论会总结。http://www.cde.org.cn/dzkw.do?method=largePage&id=312586

来源:Internet


