您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-05 11:16
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.青峰药业富马酸丙酚替诺福韦片即将获批。青峰药业富马酸丙酚替诺福韦片3类仿制上市申请进入“在审批”阶段,即将获批上市,有望成为继成都倍特之后该品种第二家获批的仿制药。富马酸丙酚替诺福韦片(TAF)原研由吉利德开发,是一种新型替诺福韦靶向前体药物,于2016年11月在美国获批,2018年11月获批进入中国,用于治疗成人和青少年(12岁以上,体重至少为35kg)的慢性乙型肝炎(HBV)。
2.嘉和生物英夫利西单抗申报上市。11月2日,嘉和生物宣布已就GB242英夫利西单抗生物类似药向国家药品监督管理局递交新药申请。根据NMPA官网信息,除强生的原研药类克(英夫利西单抗)外,中国尚无英夫利西单抗生物类似药获批上市。于中国进行英夫利西单抗相关研究的4家企业中,嘉和生物、海正药业、迈博药业已提交新药申请,其余1家(Celltrion)正在进行III期试验。2019年该品种的中国市场规模约为人民币6亿元。
3.康方生物公布2款双抗新药最新临床数据。康方生物在2020年中国肿瘤免疫治疗会议上公布了PD-1/VEGF双抗(AK112)和PD-1/CTLA-4双抗新药cadonilimab(AK104)最新临床试验数据。研究显示两款候选药在抗肿瘤方面均展现了积极结果。其中,AK112针对PD-1抑制剂不敏感型实体瘤患者效果良好,cadonilimab疗效数据显著优于联合疗法。值得一提的是,cadonilimab已在美国获快速通道资格,并在中国被纳入突破性治疗品种名单。
4.太景生物抗流感新药在美国获批临床。太景生物帽依赖性核酸内切酶抑制剂TG-1000获FDA批准,即将在美国开展临床试验。临床前研究显示,TG-1000能有效对抗A型、B型流感及禽流感;且不受48小时内服药黄金期之限制,在症状出现72小时后服药仍然有效;也不易受到流感病毒变异的影响而产生抗药性,具有一次疗程仅需服药一次之潜力。目前,TG-1000胶囊正在中国开展一项针对成人的甲型和乙型流感治疗的Ⅰ期临床。
5.CEPI与三叶草生物扩大S-三聚体新冠疫苗合作。CEPI(流行病防范创新联盟)宣布将继续资助支持三叶草生物“S-三聚体”重组亚单位新冠疫苗的开发直至其获得上市许可,这包括预计在2020年底前启动的全球关键性II/III期临床研究。CEPI的总资助高达3.28亿美元,其中包括此前宣布的6,950万美元(先期资助已用于临床前研究、I期临床和II/III期临床准备工作)。积极的I期临床初步数据表明,这款疫苗具有良好的耐受性,并能诱导出强的中和抗体和偏向Th1的细胞免疫反应,值得进行持续评估。
国际药讯
1.FDA有望批准首款软骨发育不全疗法。FDA受理BioMarin Pharmaceutical公司C型利钠肽类似物vosoritide的新药申请,用于治疗软骨发育不全(achondroplasia)儿童患者。这是FDA首次受理软骨发育不全疗法的上市申请,预计2021年8月20日前做出回复。在一项Ⅲ期临床试验中,vosoritide可以有效促进软骨发育不全儿童的骨骼生长,而且在注射一年后仍然有效。这一试验数据已于近日在《柳叶刀》正式发表。
2.Provention Bio在美递交Teplizumab的滚动上市申请。11月2日,Provention Bio公司宣布已向FDA提交了抗体药物teplizumab的滚动生物制品许可申请,用于预防或延缓1型糖尿病(T1D)高危人群。Teplizumab是一款靶向T细胞表面CD3抗原的单克隆抗体,其发表于《新英格兰医学杂志》的一项临床数据显示,teplizumab能延迟1型糖尿病发病2年时间甚至更长。如果获批,teplizumab有望成为T1D的首个疾病修饰疗法。
3.吉利德JAK1抑制剂在欧盟申报新适应症。欧洲药品管理局(EMA)受理了吉利德科学与Galapagos NV联合开发的口服JAK1抑制剂Jyseleca(filgotinib)的新适应症上市申请。该药拟用于治疗对常规疗法或生物疗法反应不足、失去反应或不耐受的中重度溃疡性结肠炎(UC)成人患者。在一项Ⅱb/Ⅲ期SELECTION研究中,200mg filgotinib治疗组在第10周达到临床缓解并在第58周维持缓解的患者比例方面显著高于安慰剂组、并且有显著更高比例的患者实现6个月无皮质类固醇缓解。
4.BMS创新TYK2抑制剂Ⅲ期临床结果积极。百时美施贵宝(BMS)公司创新口服TYK2抑制剂deucravacitinib(BMS-986165),在治疗中重度斑块状银屑病患者的首个关键性Ⅲ期临床试验POETYK PSO-1中达到双重主要终点。deucravacitinib与安慰剂组和活性对照组相比,更多患者达到PASI 75(PASI 75表示银屑病面积和严重指数改善至少75%)的症状缓解标准,deucravacitinib组有更多患者达到皮肤症状全部清除或接近清除。deucravacitinib是首个在Ⅲ期临床中显示积极疗效的创新口服特异性TYK2抑制剂。
5.Celltrion修美乐生物类似药达Ⅲ期研究终点。Celltrion Healthcare阿达木单抗生物类似物CT-P17治疗类风湿关节炎(RA)的Ⅲ期临床积极结果发布在ACR 2020年会上。结果显示,CT-P17与参照药阿达木单抗疗效相当,在24周时患者ACR20有效率为82.7%(268/324)。在ACR20/50/70缓解率、平均DAS28(CRP)、临床疾病活动指数(CDAI)、简化疾病活动指数(SDAI)和EULAR(CRP)反应方面,也达到其他次要疗效终点。临床中CT-P17的安全性与参照药阿达木单抗相当,大多数不良事件的强度均为1级或2级。
6.罕见病基因疗法PR001获FDA快速通道资格。Prevail Therapeutics宣布,FDA已授予其在研基因疗法PR001治疗神经病变型戈谢病(nGD)的快速通道资格。戈谢病共分为3种类型,包括Ⅰ型(非神经病变型)、Ⅱ型(急性神经病变型)、Ⅲ型(慢性或亚急性神经病变型)。Prevail公司预计将在2020年下半年启动PR001治疗Ⅱ型戈谢病的Ⅰ/Ⅱ期临床(PROVIDE)的患者入组。PR001此前已获FDA授予治疗nGD的罕见儿科疾病认定,以及治疗戈谢病的孤儿药资格。
医药热点
1.日本《2020年版医药代表白皮书》发布。日本医药代表认证中心发布了《2020年版医药代表白皮书》,截至3月底,日本医药代表人数为57158人,比去年减少了2742 人(其中国内药企减少1992人,外资药企减少1052人),年度减少人数又创历史新高。不过CSO公司的医药代表人数比去年增加了303人,总人数达到了3917人。据日本业界预测,持续减少的这种趋势还将持续,到2030年,日本医药代表人数可能只有4万人的规模。
2.意大利护士全国大罢工。由意大利全国护士联合会发起并组织的护士24小时全国大罢工活动11月2日如期举行。意大利国家高级卫生研究所统计资料显示,从新冠疫情暴发至今已有超过4.2万名医护人员和医疗工作者确诊感染新冠病毒。在抗击第二波疫情不到两个月时间内,平均每天80名医护人员被感染,并造成了110名医护人员染疫不治。此次罢工旨在为护士争取更多的防疫保护保障权益,将有150万个护理工作岗位受到影响。
3.瑞金医院完成亚洲首例热球囊射频消融手术。10月26日,上海交通大学医学院附属瑞金医院心律失常团队完成亚洲首例热球囊射频消融手术。常规的导管射频消融手术需要一个点一个点进行,一般需要30分钟左右完成双侧肺静脉隔离。而该院采用的全球首款可视化热球囊(将射频消融和球囊相结合的一种新技术)仅需1-2分钟的消融时间,便可完成单根肺静脉隔离,极大加快了手术。此次临床研究验证了热球囊导管在亚洲人群中使用的安全性和有效性。
股市资讯
【天士力】子公司“江苏帝益”产品TSL-1806获得药物临床试验批准通知书。TSL-1806是一种全新结构的选择性GPR40激动剂,预期可单独使用或者联用治疗2型糖尿病。
【凯普生物】子公司广州凯普医药科技有限公司取得医疗器械注册证书,名称“CYP2C9、VKORC1基因多态性检测试剂盒(PCR+导流杂交法)”,用于基因指导华法林用药,可以降低血液栓塞性疾病患者的不良反应发生率。
【万泰生物】公司新型冠状病毒抗原检测试剂盒(胶体金法)于近日获得欧盟CE认证,用于定性检测人口咽/鼻咽拭子标本中的新型冠状病毒(SARS-CoV-2)核衣壳蛋白抗原。
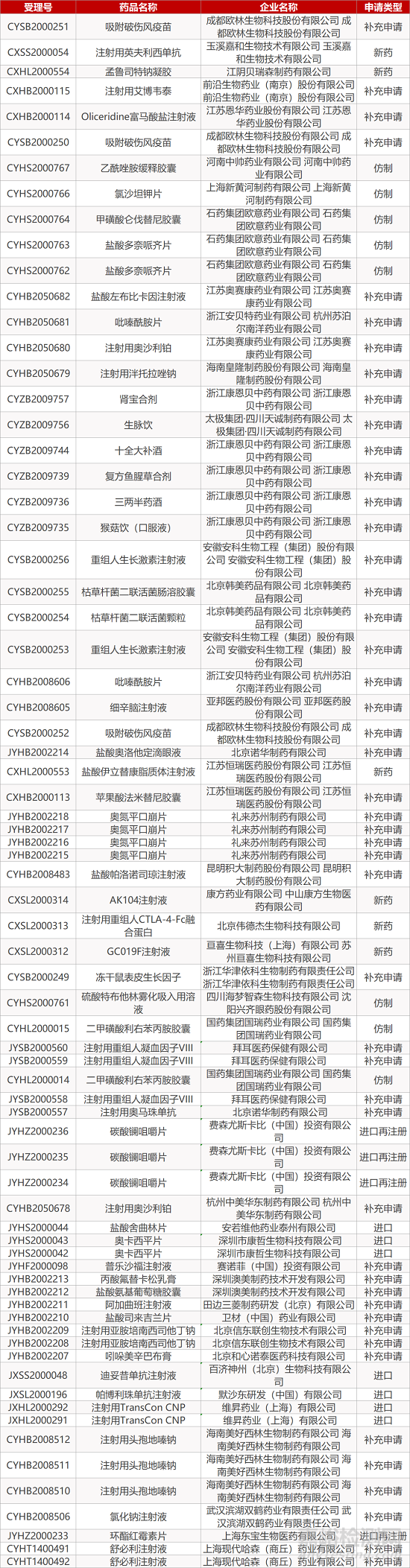
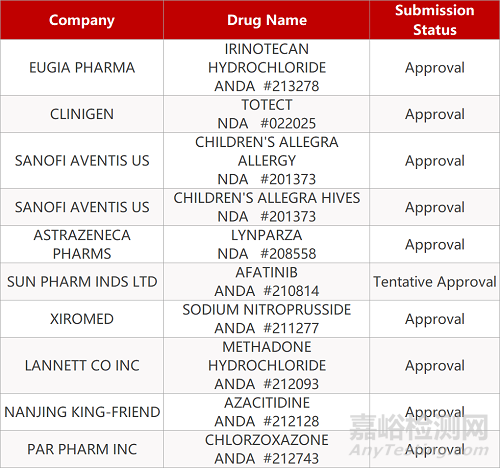
审评动向
- The End -

来源:药研发


