您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-12 09:08
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
诺华长效降脂药在华启动III期临床。诺华PCSK9靶向siRNA药物Inclisiran注射液在国内登记启动一项III期临床。这是一项国际多中心临床,旨在评估与安慰剂相比,KJX839在从基线至第330天降低LDL-C方面的优势,主要终点指标为LDL-C从基线至第330天的百分比变化。该试验由复旦大学附属华山医院的李勇主任医师担任PI。作为长效降脂药,Inclisiran 仅需每年皮下注射给药两次即可有效降低LDL-C的水平,该药目前已在美国和欧洲申报上市。
国内药讯
1.瑞复美在华新适应症即将获批。新基/百济神州瑞复美(来那度胺胶囊)在国内的第三个上市申请审评状态变更为"在审批",有望近期获批上市,联合利妥昔单抗用于治疗复发或难治性惰性淋巴瘤(滤泡型淋巴瘤或边缘区淋巴瘤)患者。原研来那度胺是新基开发的新一代口服免疫调节药物,目前该药已被批准用于骨髓增生异常综合症(MDS)、多发性骨髓瘤(MM)、套细胞淋巴瘤(MCL)和T细胞白血病的治疗。百济神州拥有该药在中国的独家经销权。
2.齐鲁制药罗米司亭启动III期临床。齐鲁制药罗米司亭生物类似药QL0911登记启动一项用于肿瘤化疗相关血小板减少的III期临床。罗米司亭是第二代口服TPO-R激动剂类药物,最早于2008年7月在澳大利亚上市,其后相继由FDA、EMA批准上市,用于免疫性血小板减少性紫癜的二线治疗,具有起效快、给药频率低、安全性更优等特点。目前国内同品种除原研(协和发酵麒麟)在4月报上市外,另有4家企业在研,除齐鲁外均处于早期临床。
3.信达CD47单抗治疗晚期恶性肿瘤结果积极。信达生物将于SITC2020年会上公布其CD47单抗(IBI188,Letaplimab)在美国开展的Ⅰa期临床NCT03763149结果。该研究共入组20例经标准治疗失败的晚期恶性肿瘤患者,Letaplimab完成了所有预设剂量的爬坡,最高探索剂量为30mg/kg QW,各剂量组均未发生剂量限制性毒性,整体耐受性良好。与治疗相关的不良事件大部分为1-2级,无导致永久停药的药物相关不良反应,无治疗相关死亡发生。同时,IBI188单药也在此项研究中观察到了一定的抗肿瘤活性,其中包括几例患者获得了较长时间的疾病稳定。
4.康宁杰瑞HER2双抗联合PD1/CTLA4双抗临床进展。江苏康宁杰瑞抗HER2双抗KN026联合PD-L1/CTLA-4双抗KN046治疗晚期HER2表达实体瘤的Ib期临床结果积极。25例患者接受三个剂量组KN026+KN046治疗。KN026联合KN046安全耐受性良好,未观察到剂量限制性毒性,3级及以上治疗相关不良事件发生率为23~24%。在14例可评估患者中,客观缓解率为64.3%,疾病控制率为92.9%,中位无进展生存期和中位总生存期尚未达到。KN026联合KN046的抗肿瘤活性不受既往曲妥珠单抗和抗PD-1免疫检查点抑制剂以及PD-L1表达状态的影响。详细数据将于SITC2020年会上公布。
5.恒瑞医药PD-L1/TGF-β抗体许可给韩国东亚公司。恒瑞医药与韩国DONG-A ST CO., LTD.公司(东亚公司)达成协议,以1.3927亿美元交易总额将抗肿瘤药品SHR-1701(PD-L1/TGF-β RII抗体)项目许可给东亚公司,同时获得东亚公司的销售分成。东亚公司将获得SHR-1701在韩国的独家临床开发、生产和市场销售的权利,被许可进行研发和销售SHR-1701用于所有人类疾病。SHR-1701是一款PD-L1/TGF-β RII双功能性免疫疗法,目前正在中国开展多项临床,适应症涉及恶性肿瘤、胰腺癌和非小细胞肺癌。
国际药讯
1.CureVac新冠mRNA疫苗Ⅰ期临床结果积极。CureVac公司新冠mRNA疫苗CVnCoV公布其Ⅰ期临床积极结果。18-60岁志愿者相隔28天接种两次CVnCoV或安慰剂。在首次疫苗接种后第43天,12 µg CVnCoV疫苗组患者体内诱发的中和抗体水平与康复者血清的水平相当;在血清型阳性的COVID-19患者中,中和抗体滴度在接种疫苗之后也显著提高并且维持在稳定的高水平;试验中无严重不良事件。预计今年年底启动12 µg CVnCoV的Ⅱ/Ⅲ临床试验,并于明年第一季度向欧盟EMA递交监管申请。
2.Arcturus新冠疫苗Ⅰ/Ⅱ期临床结果积极。Arcturus公司与杜克-新加坡国立大学医学院联合开发的mRNA新冠疫苗ARCT-021在Ⅰ/Ⅱ期临床中获积极结果。总计106名21-80岁的志愿者接受1剂疫苗或2剂疫苗。初步结果显示,所有剂量均能够剂量依赖性地激发针对新冠刺突蛋白的抗体,而且中和抗体几何平均滴度与康复者血清的水平相当;ARCT-021同时激发CD4阳性T细胞反应,和CD8阳性T细胞反应。Arcturus计划在后期临床中检验7.5 µg ARCT-021一次接种或两次接种的保护效果。
3.Keytruda组合一线治疗肾细胞癌结果积极。默沙东与卫材宣布,由PD-1抑制剂Keytruda和多受体酪氨酸激酶抑制剂Lenvima构成的组合疗法,在一线治疗晚期肾细胞癌(RCC)的关键性Ⅲ期临床中达主要终点和关键性次要终点。与活性对照组相比,Keytruda+Lenvima显著提高患者的无进展生存期(PFS)、总生存期(OS)和客观缓解率(ORR)。详细结果将在医学会议上公布。同时,两家公司计划与全球的监管机构讨论这些数据并递交监管申请。
4.安进/阿斯利康TSLP抗体达Ⅲ期临床终点。安进与阿斯利康联合开发的“first-in-class”TSLP单抗tezepelumab,在治疗重度哮喘的Ⅲ期临床NAVIGATOR中达主要终点。与安慰剂联合标准治疗(SoC)相比,tezepelumab联合SoC使患者的年哮喘急性发作率(AAER)具有统计学意义的显著下降。在基线嗜酸性粒细胞计数<300个细胞/微升的患者亚组中,tezepelumab也达到主要终点,在基线嗜酸性粒细胞计数<150个细胞/微升的患者亚组中也观察到类似的AAER减少。NAVIGATOR是首个通过靶向TSLP对重度哮喘患者提供益处的Ⅲ期临床。
5.Immune-Onc新型免疫疗法IO-202获FDA孤儿药资格。Immune-Onc Therapeutics靶向免疫抑制性受体LILRB4的创新抗体药IO-202获FDA授予孤儿药资格,适应症为急性髓系白血病。阻断LILRB4可以解除癌细胞对免疫系统的抑制,激活T细胞的杀伤性。今年9月,IO-202已进入临床阶段,完成首例患者给药。德克萨斯大学MD安德森癌症中心的Courtney DiNardo博士将在ASH2020年会上公布IO-202的作用机理、临床前数据和临床试验设计。
6.胰腺癌药物Devimistat获FDA快速通道资格。FDA授予Rafael公司用于治疗转移性胰腺癌的在研靶向药物CPI-613®(devimistat)快速通道资格。CPI-613®是一款靶向线粒体三羧酸(TCA) 循环(癌细胞线粒体中参与细胞能量代谢酶过程)的同类首个临床先导化合物,目前已获FDA批准进行胰腺癌(AVENGER500®)和急性髓系白血病(ARMADA 2000)的关键性III期临床,并获FDA授予孤儿药资格,用于治疗胰腺癌,急性髓系白血病,骨髓增生异常综合症,外周T细胞淋巴瘤, Burkitt淋巴瘤和软组织肉瘤。
医药热点
1.雷海潮任国家卫健委副主任。人力资源社会保障部11月10日通报,国务院任免国家工作人员。任命雷海潮为国家卫生健康委员会副主任。雷海潮曾任卫生部政策法规司副处长、处长,北京市卫生局副局长,北京市卫生计生委党委委员、副主任,北京市卫生计生委党委书记、主任等职。机构改革后,雷海潮于2018年11月出任北京市卫健委党委书记、主任。
2.中方回应巴西暂停中国新冠疫苗Ⅲ期试验事件 。针对“巴西国家卫生监督局(ANVISA)因一起“严重不良反应”事件暂停中国科兴在当地进行的CoronaVac疫苗III期临床”新闻热点,科兴生物11月10日于官网发布了“关于新冠灭活疫苗巴西Ⅲ期临床研究暂停的情况说明”。该公司表示,“已经注意到媒体相关报道。经与巴西合作伙伴布坦坦研究所沟通,该所负责人认为这一事件与疫苗无关。科兴将就此事与巴西方面继续保持沟通”。除巴西外,目前尚无其他进行科兴疫苗试验的国家宣布暂停试验。
3.新一轮医保目录调整专家评审结果公布。11月11日,国家医保局发布公告称,根据《2020年国家医保药品目录调整工作方案》,近期医保局组织专家对2020年国家医保药品目录调整通过形式审查的申报药品进行了多轮评审。目前,专家评审阶段的工作已经结束,各申报企业可登陆“2020年国家医保药品目录调整申报系统”查询评审结果。下一步,国家医保局将按照工作程序组织开展谈判等相关工作。
股市资讯
【特一药业】全资子公司海南海力制药有限公司化学药品“蒙脱石散”通过仿制药质量和疗效一致性评价。
【片仔癀】公司收到国家药品监督管理局关于公司主动撤回PZH2109胶囊临床试验注册申请的《药品注册申请终止通知书》。该药品主要用于治疗非酒精性脂肪性肝炎。
【嘉应制药】全资子公司湖南金沙药业有限责任公司收到国家药品监督管理局下发的《国家药品标准(修订)颁布件》,对其主要产品接骨七厘片/胶囊的处方标准进行修订,将标准中处方项下“龙血竭”恢复为“血竭”,删除龙血竭的TLC鉴别,该标准过渡期为自标准颁布之日起12个月。
审评动向
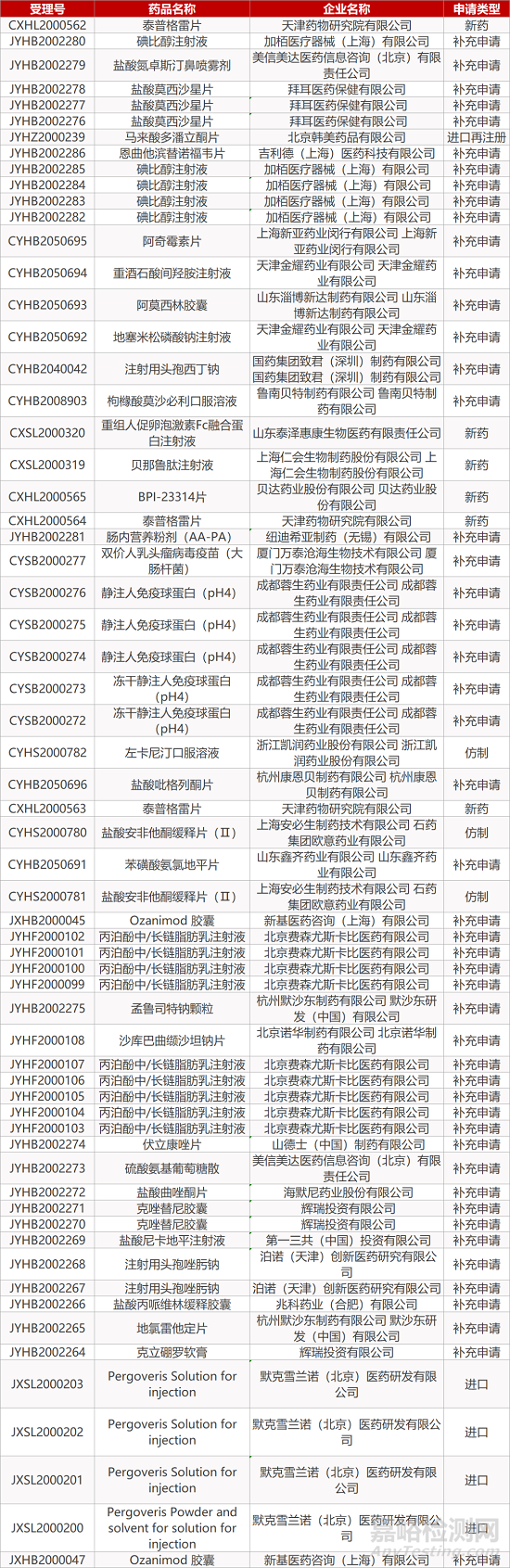
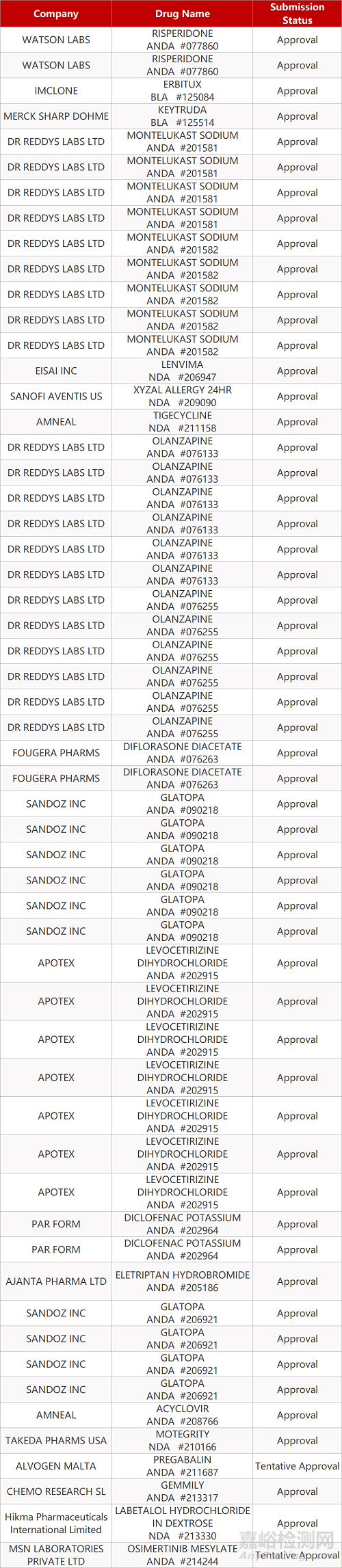
1. CDE最新受理情况(11月11日)
- The End -

来源:药研发


