您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-27 16:56
本文适用于第二类超声多普勒胎儿监护仪,其定义采用YY 0449—2009《超声多普勒胎儿监护仪》3.1,即“由主机、超声探头、宫缩压力传感器及与之相连接的仪器组成,采用超声多普勒原理,具有监测和贮存胎心率、宫缩数据的功能,并可设置报警。”如果超声多普勒胎儿监护仪作为一个系统中的一部分,则本文也适用于该部分。不适用于超声多普勒胎儿心率仪,该类仪器采用的行业标准为YY 0448—2009《超声多普勒胎儿心率仪》。
超声多普勒胎儿监护仪的结构和组成
一般由主机、超声探头、宫缩压力传感器及与之相连接的附件组成。一般的结构示意框图如下:
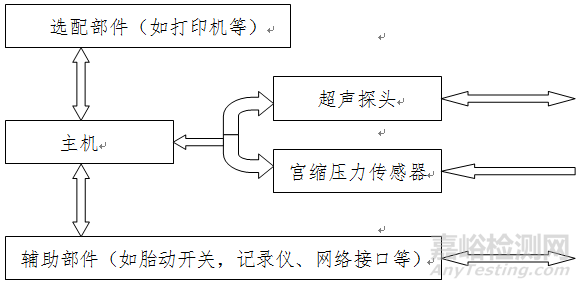
图1 产品结构示意框图
图2 产品示例
有些设备配有内置打印机的同时,还配有外部打印机或外部打印机接口;显示器也有类似情况。
超声多普勒胎儿监护仪的工作原理
超声多普勒胎儿监护仪采用超声多普勒原理对孕妇及胎儿进行连续监护,并在出现异常时及时提供报警信息。传感器一般系附在孕妇腹部,通常采用多元扁平超声多普勒换能器。
宫缩的强度通常由压力传感器反馈,进而给出所需的信号。
超声多普勒胎儿监护仪可实时监护胎儿心率等变化情况,为临床提供准确的诊断及处理资料,它既可单独使用,也可通过网络接口与产科中央监护系统连接,形成网络监护系统,也可以同时提供多种移动应用解决方案。
检测胎儿心率信号经处理后将胎儿心率变化趋势用轨迹描记出来,并能同时描记母体的宫缩曲线。
医生根据这二条曲线的变化趋势可以初步判断胎儿的健康状态,以便及时采取措施。
超声多普勒胎儿监护仪所使用的超声波生物物理特性主要有机械效应、热效应和空化效应。具体产品可能涉及以上全部或部分效应。但其强度一般很低。
超声多普勒胎儿监护仪作为非治疗设备,其设备向人体传送能量和从人体取得能量以获取所需信息。该产品用于诊断、监护,不以治疗为目的,所以超声输出的强度应尽可能地低。
超声多普勒胎儿监护仪的相关标准
|
标准编号 |
标准名称 |
|
GB 9706.1—2007 |
医用电气设备第1部分:安全通用要求 |
|
GB 9706.9—2008 |
医用电气设备第2-37部分:医用超声诊断和监护设备安全专用要求 |
|
GB 9706.15—2008 |
医用电气设备第1-1部分:安全通用要求并列标准:医用电气系统安全要求 |
|
GB/T 14710—2009 |
医用电器环境要求及试验方法 |
|
GB/T 16846—2008 |
医用超声诊断设备声输出公布要求 |
|
GB/T 16886.1—2011 |
医疗器械生物学评价第1部分:评价与试验 |
|
YY 0449—2009 |
超声多普勒胎儿监护仪 |
|
YY 0505—2012 |
医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验 |
|
YY/T 1142—2013 |
超声诊断和监护仪器频率特性的测试方法 |
|
编号 |
|---|
|
|
|---|
|
|
可预见的事件序列 |
危害处境 |
损害 |
|---|---|---|---|
|
1 |
能量的危害 |
||
|
1.1 |
电能 |
||
|
1.1.1 |
电源输入插头剩余电压 |
插头与网电源分离后,产品内滤波器剩余电压不能快速泄放。 |
导致对孕妇(和/或操作者)电击伤害。 |
|
1.1.2 |
过量的漏电流 |
绝缘/隔离效果不符合要求 |
|
|
1.1.3 |
通过应用部分(探头、宫缩传感器)引起孕妇触电 |
|
|
|
1.1.4 |
误接触高压部分 |
|
|
|
1.2 |
热能 |
||
|
1.2.1 |
非预期的或过量的传感器表面温升 |
传感器压电晶片振动的机械耗损、声阻抗匹配不佳引起的损耗和高压开关损耗。 |
引起人体组织过热或导致烫伤。 |
|
1.2.2 |
超声输出声强过高和/或辐照时间过长 |
超声波携带的机械能部分被人体吸收并转为热能。 |
|
|
1.3 |
声能 |
||
|
|
孕妇在监测过程中接受的非预期声辐射剂量 |
产品故障或失控,导致过大超声剂量作用于人体; 产品声输出控制、显示功能失效或故障。 |
可能造成人体组织细胞损伤。 |
|
1.4 |
机械力 |
||
|
1.4.1 |
操作者使传感器与人体皮肤接触时用力过大 |
操作者缺乏相关常识。 |
孕妇腹部压力过大,引起被孕妇不适。 |
|
1.4.2 |
锐边或尖角 |
主机或/和治疗头表面有锐边或尖角。 |
使用者和孕妇被划伤。 |
|
2 |
生物学危害 |
||
|
|
生物不相容性 |
|
产生致敏、刺激和细胞毒性反应。 |
|
3 |
环境危害 |
||
|
3.1 |
设备受到外界的电磁干扰 |
|
不能正常工作。 |
|
3.2 |
设备对外界的电磁辐射干扰 |
|
引起其他设备不能正常工作。 |
|
4 |
器械使用的危害 |
||
|
4.1 |
误操作 |
|
使被孕妇不适。 |
|
4.2 |
与消耗品、附件、其他医疗器械的不相容性 |
传感器上用的超声耦合剂不相容。 |
使孕妇皮肤造成不适。 |
|
4.3 |
交叉感染 |
与孕妇接触的部分清洁/消毒不充分或不正确。 |
可导致感染性疾病。 |
|
4.4 |
工作数据的准确性 |
监测数据不准确。 |
导致正确状态误报或危险状态不报。 |
超声多普勒胎儿监护仪的主要性能指标
超声多普勒胎儿监护仪的型式试验的项目应包括产品技术要求的全部项目。制造商拟定的产品技术要求也应覆盖YY 0449—2009《超声多普勒胎儿监护仪》规定的安全要求和性能要求。
超声多普勒胎儿监护仪的研究要求
1.产品性能研究
2.生物相容性评价研究
直接接触或间接接触患者(孕妇)和使用者的材料组成,应当按GB/T 16886.1—2011《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》规定的原则进行生物相容性评价,并给出清单,提供所有材料的名称和基本成分名称。
3.生物安全性研究
4.灭菌/消毒工艺研究
5.产品有效期和包装研究
6.临床前动物试验
7.按照《医疗器械软件注册技术审查指导原则》(国家食品药品监督管理总局通告2015年第50号)的要求提交软件研究资料。
8.证明产品安全性、有效性的其他研究资料。

来源:嘉峪检测网


