您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2020-12-15 18:38
可见光吸收光谱法是利用测量有色物质对某一单色光的吸收程度来进行测量的,但许多化合物本身是无色的,它对可见光不发生吸收或吸收很弱,因而必须预先通过适当的化学反应,使它转变成有色化合物,然后再进行可见光吸收光谱测定。
显色反应
在光度分析中,将试样中被测组分转变成有色化合物的反应叫显色反应。能与被测组分生成有色物质的试剂称为显色剂。
显色反应分为两类:络合反应和氧化还原反应。其中络合反应是最主要的显色反应。
对显色反应的要求:
①选择性好一种显色剂最好只与一种被测组分起显色反应,或显色剂与干扰离子生成的有色化合物的吸收峰与被测组分的吸收峰相距较远。这样干扰较少。
②灵敏度高即有色化合物的摩尔吸收系数大。
③有色络合物的离解常数要小有色络合物的离解常数愈小,络合物就愈稳定。络合愈稳定,光度测定的准确度就愈高,并且还可以避免或减少试样中其它离子的干扰。
④有色络合物的组成要恒定,化学性质要稳定。
⑤如果显色剂有颜色,则要求有色化合物与显色剂之间的颜色差别要大,以减小试剂空白。一般要求有色化合物与显色剂的最大吸收波长之差在60nm以上。
⑥显色反应的条件要易于控制如果条件要求过于严格,难以控制,测定结果的再现性就差。
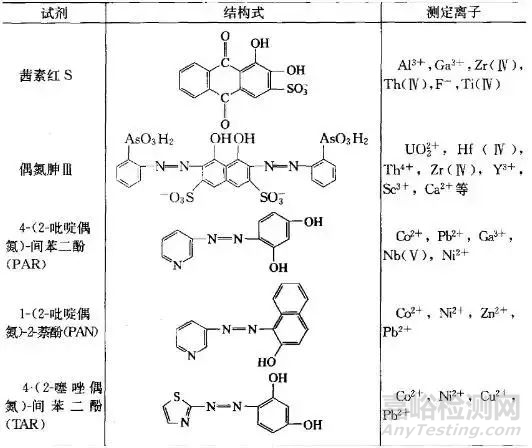
显色剂
1、无机显色剂
许多无机试剂能与金属离子发生显色反应用于光度分析,但由于灵敏度等原因,具有实用价值的仅有几类,见表1。
表1 重要的无机显色剂
2、有机显色剂
大多数有机显色剂本身为有色化合物,与金属离子反应生成的化合物一般是稳定的螯合物。显色反应的选择性和灵敏度都较高,有些有色螯合物易溶于有机溶剂,可进行萃取光度法测量。
有机显色剂种类很多,不断有新型的有机显色剂被研制出来,表2 介绍了几种常用的有机显色剂。
表2 部分常用的有机显色剂
3、多元配合物显色体系
近年来,形成多元配合物的显色体系受到关注。多元配合物是指3个或3个以上组分形成的配合物。利用多元配合物的形成可提高分光光度测定的灵敏度,改善分析特性。目前应用较多的是三元配合物。以形成三元配合物为基础,对原有的分析方法进行改进,有一些成熟的方法已纳入新修订的国家标准中。下面我们仅对三元配合物的几种类型进行介绍。
一种中心离子同时与两种配位体配合生成的具有三个组分的配合物称为三元配合物。例如Al-CASrCTMAC(铝-铬天青S-氯化十六烷基三甲铵),一种配体同时与两种金属离子形成的配合物也是三元配合物,例如[FeSnC15]。但是KAl(SO4)2不是三元配合物,因为它溶于水时,完全电离成K+、A13+、SO42-。
三元配合物在光度分析中应用较多的有:三元混配化合物、三元离子缔合物、三元胶束配合物、三元杂多酸配合物。
(1)三元混配化合物金属离子M与一种配位体(A或R)形成配位数未饱和的配合物,再与另一种配位体(R或A)形成配合物,一般通式为A-M-R,叫三元混合配位化合物,简称三元混配化合物。例如V(V)、H2O2和PAR形成1:1:1的有色配合物,可用于钒的测定,灵敏度高,选择性好。
(2)三元离子缔合物金属离子首先与配位体生成配阴离子或配阳离子(配位数已满足),再与带相反电荷的离子生成离子缔合物。主要应用于萃取光度测定。最常用的体系为金属离子(M)-电负性配位体(R)-有机碱或染料(A)体系。例如,[Ti(CNS)6]2-与二安替比林甲烷(DAM)在2~4 mol/L HCl介质中生成Ti:DAM:SCN-=1:2:6的三元离子缔合物,用氯仿萃取,λmax=420nm, ε=8×104。
(3)三元胶束配合物许多金属离子与显色剂反应时,加入表面活性剂,包括阳离子、阴离子、非离子或两性表面活性剂,形成胶束化合物。它们的吸收峰比原二元配合物向长波方向移动,测定的灵敏度提高。例如Al-CAS二元配合物的λmax=545mn,ε为约4×104,当有氯化十六烷基三甲铵存在时,形成三元配合物,Al3+:CTMAC=CAS=1:2:3,λmax变为620nm,ε为约105。
(4)三元杂多酸配合物由两种简单的含氧酸组成的复杂的多元酸,称为杂多酸,或二元杂多酸。如磷钼杂多酸,摩尔比为P=Mo=1:12。
如果杂多酸由三种简单的含氧酸组成,则为三元杂多酸。例如磷钼钒杂多酸,它的组成(摩尔比)为P:V:Mo=1:1:11。三元杂多酸比相应的二元杂多酸吸光度更高。稳定性受酸度影响较小,选择性也较好。
显示条件的选择
显色反应能否满足分光光度法的要求,除了选择显色剂以外,控制好反应条件是十分重要的。
1、显色剂用量
显色反应可用下式表示:
显色反应进行的程度可从有色配合物的稳定常数K值看出:
上式左边的比值越大,说明显色反应越完全。由于K值是常数(一般仅略受温度变化影响),因此只要控制显色剂的浓度[R],就可以控制显色反应的程度,[R]值越大,显色反应就越完全。
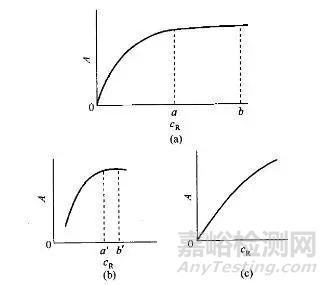
因此,加入过量的显色剂是必要的。但是显色剂过量太多,有时会引起副反应,或改变有色配合物的配位比,当显色剂本身有色时会增大试剂空白。显色剂的适宜用量可通过实验来确定。其方法是固定被测组分浓度和其它条件,取数份溶液,加入不同量的显色剂测定其吸光度,绘制吸光度(A)-浓度(c)关系曲线。一般可得到如图所示的三种情况。
吸光度与显色剂浓度的关系曲线
图(a)曲线表明,在浓度a~b范围内,吸光度出现稳定值,可在a~b选择合适的显色剂用量。
图 (b)曲线表明,显色剂浓度在a'~b'这一较窄的范围内,吸光度值比较稳定,必须严格控制显色剂浓度。
图(c)曲线表明,随着显色剂浓度增大,吸光度不断增大,必须十分严格地控制显色剂用量。
2、溶液酸度
溶液的酸度对光度测定有显著影响,它影响待测组分的吸收光谱、显色剂的形态、待测组分的化合状态及显色化合物的组成。
(1)酸度不同时,显色化合物的组成和颜色可能不同。例如Fe3+与磺基水杨酸作用,在不同的pH值条件下,能形成1:1、1:2、1:3三种配合物,现以(S.Sal)2-代表磺基水杨酸阴离子:
由此可见必须控制溶液的pH值在一定范围内,才能获得组成恒定的有色配合物,得到正确的测定结果。
(2)溶液酸度变化,显色剂的颜色可能发生变化,原因是很多有机显色剂是酸碱指示剂,其颜色随pH值变化而变化。
(3)溶液酸度过高会降低配合物的稳定性,特别是对弱酸型有机显色剂和金属离子形成的配合物影响较大。
(4)溶液酸度过低会引起金属离子水解生成氢氧化物沉淀。这种现象常发生在有色配合物的稳定度不是很大,并且被测金属离子所形成的氢氧化物的溶解度又很小的情况下。
由于酸度对显色反应的影响很大,因此,某一显色反应最适宜的酸度必须通过实验来确定。其方法是通过实验作吸光度A-pH关系曲线,选择曲线平坦部分对应的pH值作为应该控制的酸度范围。
3、温度的影响
大多数的显色反应在室温下即可进行,有些显色反应需加热至一定的温度才能完成,而有些有色配合物在较高的温度下容易分解,因此,对不同的显色反应应通过实验选择其适宜的显色温度。
由于温度对光的吸收及颜色的深浅都有影响,因此在绘制标准曲线和进行样品测定时,应使温度保持一致。
4、显色时间
所谓显色时间指的是溶液颜色达到稳定时的时间。不少显色反应需要一定时间才能完成,而且形成的有色配合物的稳定性也不一样。因此必须在显色后一定的时间内进行比色测定。通常有以下几种情况:
①加入显色剂后,有色配合物立即生成,并且生成的有色配合物很稳定。此时可在显色后较长时间内进行测定。
②加入显色剂后,有色配合物的形成需要一定时间,生成的有色配合物也很稳定。对这类反应可在完全显色后放置一定时间内进行测定。
③加入显色剂后,有色溶液立即生成,但在放置后又逐渐褪色,对这类反应,应在显色后立即进行测定。
适宜的显色时间和有色溶液的稳定程度可以通过实验来确定。方法是配制一份显色溶液,从加入显色剂起计算时间,每隔几分钟、几十分钟或数小时测定一次吸光度,绘制吸光度A-时间t曲线,从曲线确定适宜的显色时间。
5、溶剂
有机溶剂常降低有色化合物的离解度,从而提高显色反应的灵敏度。此外,有机溶剂还可能提高显色反应的速度,影响有色配合物的溶解度和组成等。利用有色化合物在有机溶剂中稳定性好,溶解度大的特点,可以选择合适的有机溶剂,采用萃取光度法来提高方法的灵敏度和选择性。
共存离子的干扰及消除
1、干扰
当溶液中的其它成分影响被测组分吸光度值时就构成了干扰。干扰离子的影响有以下几种类型:
①与试剂生成有色配合物。如用钼蓝法测硅时,磷也能生成磷钼蓝,使结果偏高。
②干扰离子本身有颜色。
③与试剂反应,生成的配合物虽然无色,但消耗大量显色剂,使被测离子的显色反应不完全。
④与被测离子结合成离解度小的另一种化合物。使被测离子与显色剂不反应。例如由于F-的存在,与Fe3+生成FeF63-。若用SCN-显色则不会生成Fe(SCN)3。
2、干扰消除方法
干扰消除的方法分为两类,一类是不分离的情况下消除干扰,另一类是分离杂质消除干扰。应尽可能采用第一类方法。
消除于扰的一般方法如下:
①控制溶液的酸度是消除干扰的简便而重要的方法。控制酸度可以使待测离子显色,干扰离子不能生成有色化合物。
②加入掩蔽剂也是消除干扰的有效和常用的方法。例如,用硫氰酸盐作为显色剂测定Co2+时,Fe3+有干扰。可加入氟化物为掩蔽剂,使Fe3+与F-生成无色而稳定的FeF63-,消除了干扰。
③利用氧化还原反应,改变干扰离子的价态,使干扰离子不与显色剂反应。
④选择适当的参比溶液,消除显色剂本身颜色和某些共存的有色离子的干扰。
⑤选择适当的波长消除干扰。
⑥采用适当的分离方法除去干扰离子。
⑦利用导数光谱法、双波长法等新技术来消除干扰。








来源:Internet


