您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-12-29 09:05
概述
FDA每年都会对有产品在美国上市的医疗器械生产商和销售商进行检查。对于医疗器械生产企业和销售企业的检查,检查结果主要以《联邦法规21章》中的要求作为衡量的标准。本文将对FDA官方检查报告中引用的法规条例进行统计和分析,带领大家了解FDA的检查重点。
1. FDA开具的不合格项概况
FDA自2008年10月1日至2020年8月19日,共开具出了217060个违反相关法例的不合格项,其中,与医疗器械相关的不合格项共40789个(19%),是除了食品以外,开具不合格项最多的类别,可见FDA对于医疗器械的监管力度之大。
2. 医疗器械类产品类不合格项引用条例概况
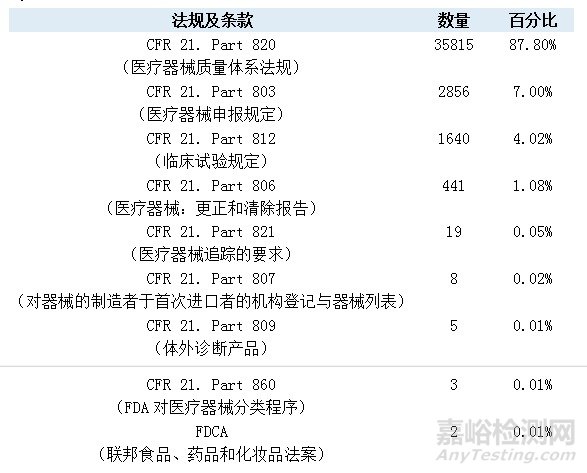
医疗器械类产品的40789个不合格项分别引用了9个不同的法规条款,包括《联邦法规21章》第820款、803款、812款、806款等条例。各条款的出现频率可参见下表。其中,近九成的引用法规条款来自《联邦法规21章》第820款。
3. 《联邦法规21章》第820款引用概况
2008年10月1日到2020年8月19日期间,FDA共引用了35815次《联邦法规21章》第820款中的相关条例。各个条例的具体引用次数可以参考下表。
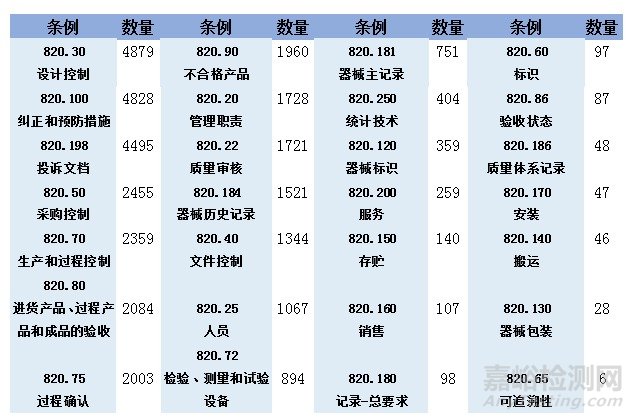
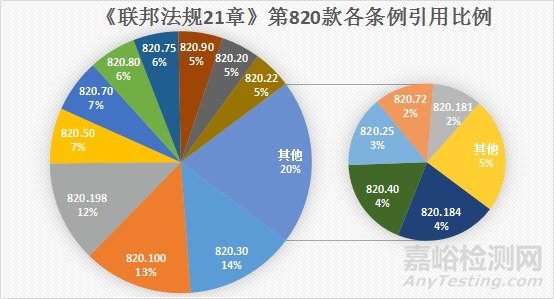
从上图中我们可以看到,在2008年10月1日至2020年8月19日FDA开具的不合格项中,《联邦法规21章》第820款中的各个条例均有涉及。其中,出现频率最高的条例包括820.30(设计控制)、820.100(纠正和预防措施)、820.198(投诉文档)、820.50(采购控制)、820.70(生产和过程控制)、820.80(进货产品、过程产品和成品的验收)、820.75(过程确认)。
总结
FDA在检查医疗器械生产和销售组织的时候,主要以《联邦法规21章》第820款作为参考依据,同时也会在需要时参考《联邦法规21章》第803、812、806款等条款。通过对引用的820条款进行的统计分析,我们发现各组织在生产和销售产品过程中的设计控制、纠正和预防措施、投诉文档、采购控制、生产和过程控制、进货产品、过程产品和成品的验收以及过程确认等部分出现不合格项的频率最高,因此,各组织应更加注重以上几个部分的程序文档的建立、行为的实施和维持。

来源:医课汇


