您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-08 17:21
溶出度即指片剂、胶囊剂或颗粒剂等普通制剂在规定条件下溶出的速度和程度,在缓释制剂、控释制剂、肠溶制剂及透皮贴剂等制剂中也称释放度,它是一种模拟口服固体制剂在胃肠道中的崩解和溶出的体外试验方法,根据Noyes-Whitney方程可知,影响溶出度的因素包括有药物的溶出面积(可通过机械粉碎或气流粉碎减小粒径等增大溶出面积)、药物的溶出速度常数(加强搅拌或提高药物的扩散系数)以及药物的溶解度(升高温度、改变晶型、制成纳米晶或固体分散物等)。体外溶出度被认为是连接体内外相关性的桥梁,是反映口服固体制剂处方工艺质量情况的一双眼睛,对处方工艺的研究具有重大的指导作用。随着质量源于设计(quality bydesign, QBD)理念在制药行业中愈发重视,在难溶性药物的新药制剂开发过程中,我们要切记制剂样品本身才是决定质量的关键因素,而溶出是产品质量体系中非常重要的一个项目。努力优化处方工艺,以药物pH-溶解度为依据指导寻找具有区分力的制剂溶出曲线是制剂研发人员工作的重中之重。那么如何建立一个有效的溶出方法呢?
在进行溶出方法开发前,处方前研究是一个非常重要的工作内容,而处方前研究,是在已完成全面、充分的文献调研基础上开始进行的实验研究,但以前很多研究者往往将其忽略在外,一上来就直奔主题,直接进行处方工艺研究,但欲速则不达,折腾一通可能还是回归起点。处方前研究最主要的工作就是完成原料药的BCS分类、渗透性、pH-溶解性试验、以及原料在不同pH溶液中的稳定性、滤膜吸附性等试验考察,在此基础之上方可开发有效的溶出方法。溶出方法开发是基于阳性药的药动学信息、考虑原料药的理化性质、剂型特点及稳定性因素,选择合适的溶出实验条件及装置,具体内容包括:溶出介质及体积、转速、表面活性剂、取样时间点的筛选及溶出方法区分力的验证。
1. 溶出实验条件筛选
1.1 溶出介质选择
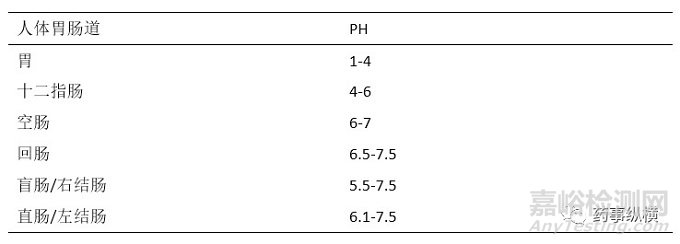
溶出介质的合理选择很大程度上依赖于对原料药自身理化性质和胃肠道液性质的了解。
溶出介质一般采用pH1.0-6.8的水性介质,温度为37℃±0.5℃,特殊情况下可采用更高pH值的溶出介质,一般不应超过pH8.0。溶出介质pH范围的确定主要依据该药物在体内吸收主要消化道部位的生理pH值。胃内pH值会随着年龄增长而发生变化,这也就是为什么有些药物在一部分人中很有效,而在另一些人中则无效的重要原因,可能就是胃内pH值不同,所以做溶出时不应该只做一个介质的溶出,而是做不同pH值的介质溶出曲线。当然,在小试研究阶段溶出度重点是通过寻找最具有区分力的溶出条件进行不同处方工艺样品的筛选考察,而不是一味的“扎进”溶出室对不同pH介质曲线进行无休止对比,要根据本制剂产品的特性“有所为而有所不为”。
1.2 溶出介质体积
溶出介质体积的选择一般是根据药物的溶解度和制剂规格确定的,以保证符合漏槽条件;常用体积一般为500、900和1000ml;药物在介质中应具有较好的物理化学稳定性。
1.3溶出装置(转篮法与桨法)及转速选择
一般根据项目经验,多采用USPⅡ法(桨法)或USPⅠ法(转篮法)溶出装置,片剂多选择桨法,胶囊剂多用于篮法,转速大部分在50~100rpm/min。篮法以100rpm/min为主,桨法以50rpm/min为主。若50 rpm低转速桨法中溶出杯底部有结块未崩散或圆锥形堆积(一般是由水不溶性辅料堆积所致),应考察75rpm,提高转速可使辅料分散的更好,使溶出不受阻碍;在充分研究论证的基础之上,选择100转速也是可以的。在溶出方法开发中一个好的诊断工具是在溶出试验结束后增加一个高转速---即在最后一次正常取样点后,将转速增加至150-250rpm维持15-30min再进行取样,这样做可以使溶出杯底部的圆锥形堆积被强制分散同时使未溶解的API的溶解。这种做法可以快速检查制剂的含量,并确保溶出不是受到溶解度的限制或者低的溶出量不是由含量低引起的。
1.4表面活性剂筛选
对于水不溶性或难溶性药物,可以考虑在介质中加入适量的表面活性剂使其溶解度增加。但选择加入表面活性剂往往是“The last choice”,通常在确定加入表活之前,应进行以下研究:不含表面活性剂的常规介质及常规低转速下(桨法50rpm或篮法100rpm)溶出曲线考察、提高转速(75rpm、100rpm、150rpm)、增加采样时间点考察,若在规定截止时间内,所有介质、方法的溶出度均达不到85%以上,则考虑加入表活。十二烷基硫酸钠是首选的表活,因为不同来源的表面活性剂质量参差不齐,可能对溶出实验结果带来显著影响,所以选择SDS应使用高纯度级并尽量固定厂家来源。
关于表面活性剂的使用量,在《普通口服固体制剂溶出曲线测定与比较指导原则》中规定:表面活性剂浓度推荐在0.01%-1.0%(W/V)范围内依次递增考察,特殊品种可适度增加浓度,此时应有研究说明。1.5 取样时间点及溶出曲线测定
取样时间点的确定主要根据制剂本身特性及方法追踪处方核心属性的能力。例如:若产品为快速溶出制剂,则应该缩短取样时间间隔,可间隔5、10或15min取样;若溶出较慢,可适当增加取样间隔时间;若希望更好的研究或追踪崩解效应,5min或10min时间点都是必须的。采样时间点应确保产生足够的样品量,直至药物溶出度达85%以上或达到溶出平台。绘制得到的溶出曲线最好是有一定弧度的曲线,即开发出足够多的时间点以充分表征上升期和平台期,无拐点和突释的溶出曲线。一定弧度的溶出曲线才能更科学、合理的桥接人体内的生物利用度,才能保证制剂具有更好的内在品质。
2.溶出方法区分力的验证
溶出方法区分力即指通过溶出数据可以发现和区分固体制剂质量变化的情况。作为创新药研发阶段的溶出方法,体外溶出试验必须具有良好的区分力:即当影响处方筛选或体内行为的处方/工艺参数发生变动时,可通过溶出结果判断这些变动情况。创新药在研阶段影响制剂溶出因素可能包括:原料药晶型、原料粒径、辅料、制粒的硬度和粒径分布及片剂硬度等,故具有区分力的溶出方法在前期处方工艺研究中占据重要比例,但是也要注意的一点是区分力的适度拿捏,不可无区分力,亦不可过度区分,创新药在研阶段最理想的区分力溶出条件即:可区分API晶型、粒径、辅料类型及用量等变化所导致的溶出差异;可区分制粒、压片阶段关键质量参数发生变化所导致的溶出差异;可区分处方工艺变更、小试工艺放大、生产地点或规模发生变化所导致的溶出差异等。而溶出方法的过度区分,其实并没有严格的定义,因为不同制剂产品溶出特性有所不同,关键还是取决于原料药本身的理化性质和体内药动/药效学性质,简单理解,借用谢沐风老师的话讲,就是将原研制剂的批间差异都给区分了,秉持着不怀疑原研质量的出发点,此时的试验条件就是区分过度,亦或者把与用药患者无关的变异性区分开来等。所以区分力的“度”还是要拿捏得当,引用谢老师的话讲:玩儿技术,关键是实用!
根据制剂产品本身特性以及在处方工艺开发及生产工艺中可能影响制剂内在质量的关键因素,专门设计一些异常状态下生产的片剂,例如通过调整制备工艺(例如,改变素片硬度)或处方(例如,更改崩解剂用量)有意制备质量有差异的制剂,以考察溶出方法的区分能力,溶出趋势差异较大证明有区分力。
2.1 不同原料粒径对溶出行为的影响
依据Noyes-whitney方程,理论上原料粒径的变化将会影响片剂的溶出行为。因此,可使用粒径分布不同的批次原料药自制颗粒,其它湿法制粒参数不变,制得的颗粒压制成片,考察不同原料粒径对溶出曲线的影响。一般粒径越小,溶出度越大,而且随着片剂逐渐崩解,原料从颗粒中释放,这种差异会变得愈发明显,这种溶出曲线的差异变化即可说明筛选出的介质具有较好的区分力。
2.2 不同硬度片剂对溶出曲线的影响
可通过压制不同硬度的自制片,考察硬度对溶出的影响。根据项目经验,一般硬度会设置低、中、高硬度,且硬度越大的素片,溶出度越低,即可说明筛选出的介质具有较强的区分能力。
2.3 崩解剂用量对溶出曲线的影响
可加入不同崩解剂用量从而改变颗粒性质的处方,考察其对溶出曲线的影响。自制不同批次颗粒,崩解剂用量分别占处方量为不同比例,且保证其它制粒参数不变,考察不同崩解剂用量对溶出曲线的影响。依据项目经验,正常情况下崩解剂加入比例越多时的溶出最快,比例越少时最慢,照此就可以区分出因崩解剂用量不同而导致颗粒性质有差异的片剂。
具体案例分析
xxx片依据药典方法进行的溶解度研究结果如下:
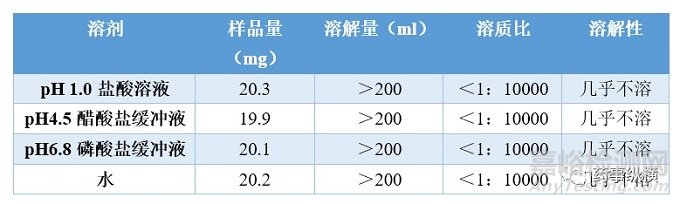
从表可看出:原料药在四种常规介质中几乎不溶,属于BCS Ⅱ类水难溶性药物,且溶解度受pH影响不大,后续可考虑在水加入一定量的表面活性剂作为溶出介质。
接下来筛选表面活性剂的浓度,设置0.1%SDS、0.3%SDS、0.5%SDS、0.7%四种浓度的介质,模拟溶出条件,将0.1g原料加入1000ml介质,50rpm不同时间点取样测定溶出曲线。
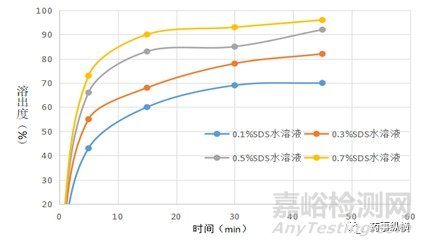
图1. 原料药在不同SDS浓度水溶液中的溶出曲线
结果发现原料药在不同浓度SDS水溶液中的溶出存在显著差异,在0.1%SDS和0.3%SDS水溶液中45min时的溶出度均低于90%;而在0.5%和0.7%SDS水溶液中45min的溶出度均可达到90%以上,在这种情况之下我们的初步选择依据是:当溶出曲线不重合时,选择最终释放量在90%以上,溶出最慢的介质。因此,选择SDS用量较少且溶出速度相对较慢的0.5%SDS水溶液作为本品的溶出介质。
测定片剂样品在三种不同浓度SDS水溶液中的溶出曲线,研究发现片剂在0.5%SDS和0.7%SDS水溶液中45min溶出度均大于95%,而0.3%SDS溶液中45min溶出度低于90%,因此最终确定选择桨法50rpm、以1000ml0.5%SDS水溶液为溶出介质。
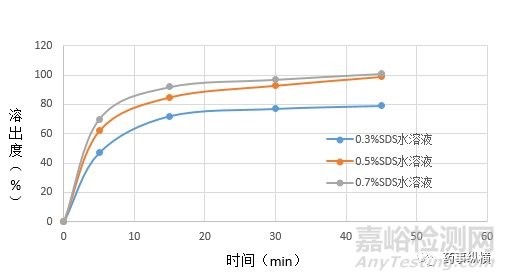
图2. 片剂在不同浓度SDS介质中的溶出曲线
溶出方法区分力验证
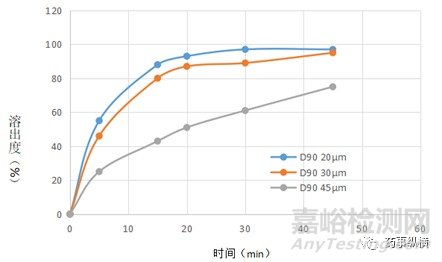
图3 不同粒径原料药在0.5%SDS水溶液中的溶出曲线
不同粒径的原料对片剂的溶出度影响显著。粒径越小,溶出度越大,而且随着片剂逐渐崩解,这种差异变得越明显,45min时D9045μm粒径的溶出度不到80%。因此,以上数据表明,0.5%SDS水溶液可以区分出由不同粒径原料所制备的片剂,溶出介质具有区分力。
不同崩解剂用量会影响片剂的崩解时间,崩解剂加入比例越多溶出最快,1%崩解剂溶出最慢,而10%崩解剂用量的片剂溶出最快,在15min左右差异最为明显。因此,综合以上数据可以得出:0.5%SDS水溶液既可以区分出原料药粒度的差异,同时可以区分出因崩解剂用量不同而导致颗粒性质有差异的片剂。
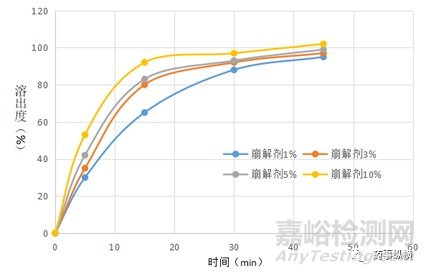
图4 不同崩解剂用量在0.5%SDS水溶液中溶出曲线
综上,溶出是丈量制剂内在质量的一把尺子,只有对体外溶出度实验进行全面深入细致的研究,才能更为科学、有效的间接评价和提高用药患者体内生物利用度。且在创新药研发阶段,建立科学合理的溶出方法是一个动态过程,会随着处方研究工作的推进不断有所调整,在该过程中开发具有区分力的的溶出方法、确定合理的溶出试验条件及实验参数是制剂科研人员的工作关键所在,严格控制制剂产品的内在质量品质,才能更多的受益于用药患者。
参考文献:
[1] 中国药典2015版
[2] 药剂学. 人民卫生出版社
[3] 速释固体口服制剂质量控制溶出方法开发策略
[4] 难溶性药物的溶出试验中使用表面活性剂时注意事项
[5] 普通口服固体制剂溶出曲线测定与比较指导原则
[6] 具有区分力的溶出方法开发
[7] 浅谈溶出度检查方法的分辨力
[8] 论溶出(释放度)试验条件的选择对药物体内外相关性的影响
[9] 适度区分力溶出方法的开发细节及要点
[10] 具有区分力的溶出曲线

来源:药事纵横


