您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-12 17:37
镁有良好的生物相容性且易被人体吸收,是有前途的支架材料。通过激光切割制造支架已经成为行业标准。我们使用光化学蚀刻将支架的图案转移到镁板上替代激光切割。在这项研究中,我们提出了建立和验证支架原型的三个阶段,包括使用有限元分析进行设计和模拟,然后基于AZ31合金进行制造,最后在家猪的外周动脉中进行体内测试。
01、研究内容简介
心血管疾病非常普遍,每年占全球死亡人数的30%。一种称为经皮腔内血管成形术(PTA)的带有支架的微创手术在20世纪90年代被引入来治疗这种疾病。PTA显示出许多优点,如高效、易于实施、仅造成轻微创伤,并确保低感染率。然而,由不锈钢、钴铬合金或钛基合金制成的传统支架不断被研究潜在的故障和改进,以解决临床和工程界的任何问题。副作用虽然罕见,但与再狭窄、血栓形成、假性动脉瘤形成和栓塞有关,可能导致短期和长期的发病率和死亡率。有时,在装置在体内的寿命期间,支架的失效可能是由材料性能的下降和由于设计不当造成的结构完整性差引起的。心血管支架在展开过程中承受静载荷,或因脉动血压而周期性疲劳。弯曲、扭转、张力和患者运动和肌肉收缩造成的压缩也是罕见支架失效的原因之一。影响支架性能的其他因素有材料特性、装置设计和制造工艺。考虑到相对短期的需要和传统金属支架的潜在并发症,替代生物降解支架提供了很大的改进。由于血管开始愈合,随后很快发生再内皮化,支架植入过程只需是暂时的,仅限于血管再建模所需的时间。生物可降解支架可以由聚合物或生物可降解金属制成。人体会将这些物质转化为腐蚀产物,既可以吸收,也可以排出体外。生物可降解金属如铁、锌、镁及其合金比生物可降解聚合物更具优势。由这些金属制成的植入物具有良好的承载能力、合理的细胞相容性,并且可在体内吸收。这些特性使得生物可降解金属更适合制造医疗器械,如手术螺钉、钢板和心血管支架。镁是生物可降解医用植入物的主要材料,因为它是人体中第四丰富的元素,也是骨组织中的一种成分。
目前支架制造的方法包括一系列不同的工艺,如激光切割、电铸、微放电加工和光化学蚀刻。大多数传统的支架是使用飞秒激光束加工制造的,由于材料升华、高速加工和可忽略的热变化,这种加工提供了最小的浪费。我们相信在支架制造中有替代方法的空间,以避免部分金属氧化、热应力积累、浮渣的表面沉积、昂贵的金属管和复杂的激光制造设备。我们的专利方法是基于光化学蚀刻将支架的图案转移到任何可降解的金属片上,AZ31镁合金已经证明了这一点。光化学蚀刻是形成支架纹理的一种简单且廉价的操作。该程序不需要在制造后对装置进行任何后处理。我们在这里报道的学术成果,探索了用于加工可生物降解金属支架的光化学蚀刻,特别是由AZ31制成的支架。人体内高浓度的铝可能会影响这种元素的毒性。然而,AZ31支架的显著低质量(50毫克)和其中铝的最低浓度(仅2-3%)以及支架在体内的延长降解时间,提供了这种元素的毒性水平不会受到关注的信心。已经证明,AZ31的体内降解不会引起任何细胞毒性,并且在生物环境中不会产生有害影响。
本研究首次提出了基于AZ31镁合金的光化学蚀刻镁支架的体内初步研究,在外周动脉环境中使用有限数量的猪模型。获得的结果突出了生物宿主反应和支架降解过程,这是一个非常复杂的现象。
有限元分析模型用于确定卷曲和膨胀时的最大径向变形值。支架径向膨胀,直到观察到塑性变形开始,并达到材料的极限拉伸强度。如图1所示,所有最大径向变形都是通过取径向(Y轴)方向上节点的最小变形获得的。随着压接过程中压力的增加,支架倾向于径向向内变形。在卷曲过程的最初几个步骤中,径向变形非常小,然后,由于施加的压力,它开始径向变形。类似地,在扩张过程中,作用在支架表面的压力切换到相反的方向。我们推测,在初始加载阶段,变形和应力可能处于弹性状态。在加载的后期,变形开始出现尖峰,这表明是塑性变形状态。通过计算方法(有限元分析)计算的卷曲变形与通过卷曲制造的支架获得的实验结果一致。

图1.通过模拟过程获得支架直径变形。
支架植入后立即对右肾动脉进行光学相干断层扫描,然后在第14天和第28天再次进行光学相干断层扫描。这项研究揭示了急性时间点和终末(第28天)时间点之间的内腔损失(表1)。然而,在第14天和第28天之间,平均装置面积和直径都有所增加。右肾动脉支架段的光学相干断层扫描图像如图9所示。支架植入后拍摄的这些图像显示了良好的支架-血管附着,如图2a-c所示。此时,在动物的任何支架动脉中都没有观察到血管剥离。在第14天,可以看到突出和堆叠的支柱,表明支架仅在右肾动脉的远端降解,如图2d–f所示。在第28天获得的光学相干断层扫描图像显示整个支架段都有突出的支柱,表明支架可能在远端区域塌陷,如图2g–I所示。这种支架在体内的行为预计是由于随着时间的推移通过腐蚀导致的装置降解,最终可能导致支架部分失去机械完整性。适当的保护涂层可能会延迟这些过程。已经发现,在28天的整个植入期间,支架基本上保持完整(整体),并且部分嵌入血管壁内。
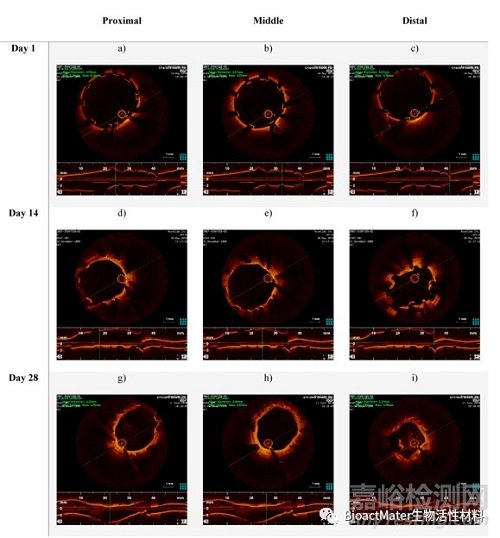
图2.D28-02动物植入支架的右肾动脉在近端、远端和中段的光学相干断层扫描图像:(a–c)第一天植入支架后;(d–f)在第14天的随访中;(g–I)在第28天的随访中。每个图像的上部示出了沿支架长度一定距离处的管腔横截面。图像的底部显示了带支架动脉的纵向横截面。请注意,在一些图像中,明亮的虚线代表金属支架支柱。
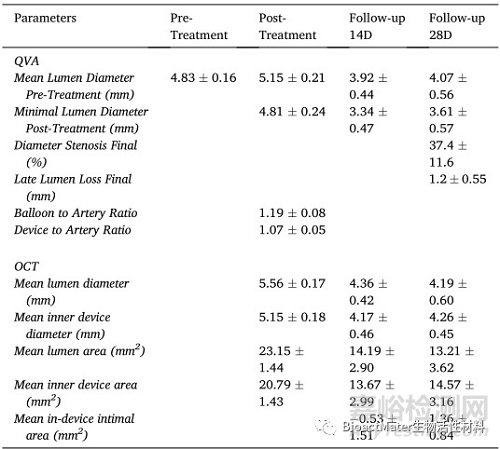
表1植入28天后支架血管的血管造影QVA和光学相干断层扫描分析数据
对安乐死后植入固定动脉组织的支架进行了显微CT检查。这项研究是使用显微计算机断层扫描和特殊软件进行的,通过根据密度对每个不同的相进行颜色编码来识别腐蚀产物。获得的图像显示在图3中。利用高端工业CT软件VGSTUDIO Max进行三维体积重建,根据材料的密度得到体积分数。图3a显示了植入前拍摄的AZ31镁菱形设计支架的显微CT图像。该图像允许计算设备的初始体积和表面积。图3b示出了植入28天后的金属和腐蚀产物,其中蓝色表示金属,黄色表示可见的设备腐蚀产物,并且可以通过密度的差异来分割。观察到多处骨折——主要在植入物的远端和近端区域。图3c显示了通过从3D重建图像中数字减去金属获得的腐蚀产物。通过显微计算机断层扫描研究,获得了金属和腐蚀产物的体积。我们推测,在体内和体外环境中观察到的腐蚀速率差异是由于体内动脉的高血流速率和强脉冲,这可能加速支架腐蚀。值得一提的是,在体内腐蚀过程中,激光焊接的连接杆在该区域内的优先降解或机械弱化方面没有表现出任何问题。我们认为这是因为在焊接过程中没有使用电极,这消除了添加与AZ31中存在的元素或材料不同的任何元素或材料,从而排除了电偶腐蚀。
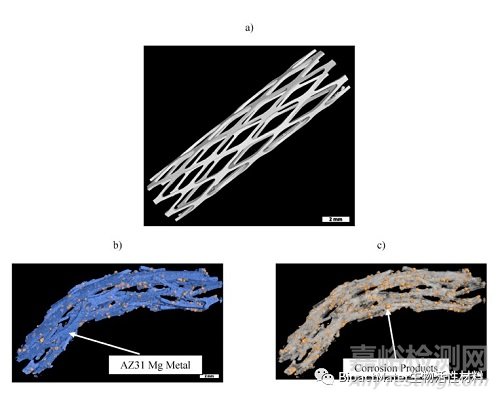
图3.高分辨率显微CT扫描获得支架植入前后的三维重建:(a)植入前AZ31菱形设计支架;解释后的金属和腐蚀产物,其中蓝色代表金属,黄色代表腐蚀产物;(c)移植后金属支架表面黄色突出的腐蚀产物。注意金属表面已经被软件人为去除。
在这项研究中,我们完成了菱形设计的AZ31镁合金支架的卷曲和膨胀的成功建模,以及由卷曲和球囊膨胀引起的计算变形。所采用的有限元分析可用于预测不同设计的支架失效,从而减少使用大量体内试验的经验工作的需要。已经证明,光化学蚀刻是制备镁基可生物降解支架的一种替代且易于实施的方法。本研究中的装置由菱形设计的AZ31镁合金制成,并通过将其成功植入家猪的外周动脉进行体内测试。通过光学相干断层扫描成像观察,支架平稳扩张,并均匀地停留在管腔壁上。在植入后的第28天,在支架动脉的近端、远端和中间部分,一些支柱错位、断裂、堆叠并突出到管腔中。微计算机断层扫描和高分辨率摄影证实了光学相干断层扫描的结果。观察到的支架退化是意料之中的,因为随着时间的推移,金属装置开始腐蚀和碎裂。然而,在28天的整个植入期内,支架几乎保持完整,部分嵌入血管壁内。获得的体内腐蚀速率为0.75毫米/年,高于体外研究报告的速率。尽管通过组织学评估观察到中度损伤和炎症,但是支架随着时间的推移降解并嵌入内膜中,并且没有发现危及生命的影响。在生理环境中,支架的提取残留物被发现涂有典型的镁腐蚀副产物。这项短期体内研究首次有效地使用了镁光化学蚀刻支架,并为其血管应用提供了有希望的初步数据。
02、通讯作者简介
Bala Subramanya Pavan Kumar Kandala
Department of Mechanical and Materials Engineering, University of Cincinnati.
Vesselin Shanov
Department of Chemical and Environmental Engineering, University of Cincinnati.
03、资助信息
本研究得到ERC国家自然科学基金通过资助“生物材料革命”项目提供的资金支持。
04、原文信息
B.S.P.K.Kandala, G. Zhang, C. Lcorriveau, M. Paquin, M. Chagnon, D. Begun, V. Shanov,
Preliminary study on modelling, fabrication by photo-chemical etching and invivo testing of biodegradable magnesium AZ31 stents,
Bioactive materials 6(6)(2021) 1663-1675.
Doi: https://doi.org/10.1016/j.bioactmat.2020.11.012

来源:BioactMater生物活性材料


