本研究基于可降解锌合金良好的材料学性能,令人满意的生物相容性以及理想的成骨活性,进一步选择具备双相成骨活性元素Sr,设计制备了可降解Zn-Sr合金体系。在体外评估Zn-Sr合金良好的成骨活性,并尝试探究了Zn-Sr合金发挥促成骨活性的作用机制,进一步建立大鼠股骨髁骨缺损模型,于体内验证Zn-Sr合金的骨缺损修复效果。
01、研究内容简介
尽管骨组织有着较强的再生修复能力,但由严重创伤、恶性肿瘤或先天性疾病引起的骨缺损,尤其是临界性骨缺损,仍需应用骨移植物才能修复。现阶段临床应用的骨修复材料主要包括骨(自体骨、同种异体骨、异种骨),生物陶瓷类(以HA、β-TCP、CaP为代表),合成聚合物类以及医用金属材料。其中自体骨以其良好的成骨,骨诱导和骨传导特性仍被认为是骨修复材料的金标准,但自体骨移植存在着供区疼痛不适、供区继发性骨缺损、可用骨量有限,与缺损处形态不匹配等缺点。而以HA、β-TCP、CaP为代表的生物陶瓷,弹性模量常高于骨组织但力学性能差,并且降解行为不可控;合成材料主要包括PLA, PCL,PGA,PLGA,其主要缺点是骨传导特性的缺失以及远低于皮质骨的力学强度和弹性模量,此外,合成聚合物材料降解产物多呈弱酸性,易引起局部炎症反应不利于骨修复。传统医用金属材料(如钛、不锈钢等)具备良好的力学强度,但这些惰性金属往往具有着远高于皮质骨的弹性模量,可以造成应力遮挡、骨量丢失等等;更重要的,这些金属材料欠缺足够的成骨活性,往往只能被用作支撑用途。
总的来说,目前的骨替代材料要么力学性能较差,如自体骨,生物陶瓷以及聚合物等,要么力学性能足够但欠缺成骨活性,如钛合金,不锈钢等。因此,一种具备良好成骨活性的可降解金属材料有望解决目前骨修复材料领域的困局。因此,在本研究中,我们基于可降解锌合金良好的成骨活性,进一步添加了具备双相成骨活性的合金元素Sr,制备了可降解Zn-Sr合金体系,于体外、体内系统评估其成骨活性,探究其发挥成骨功能的机制,为骨缺损修复尤其是临界性骨缺损及承重部位骨缺损提供一种极富前景的新选择。
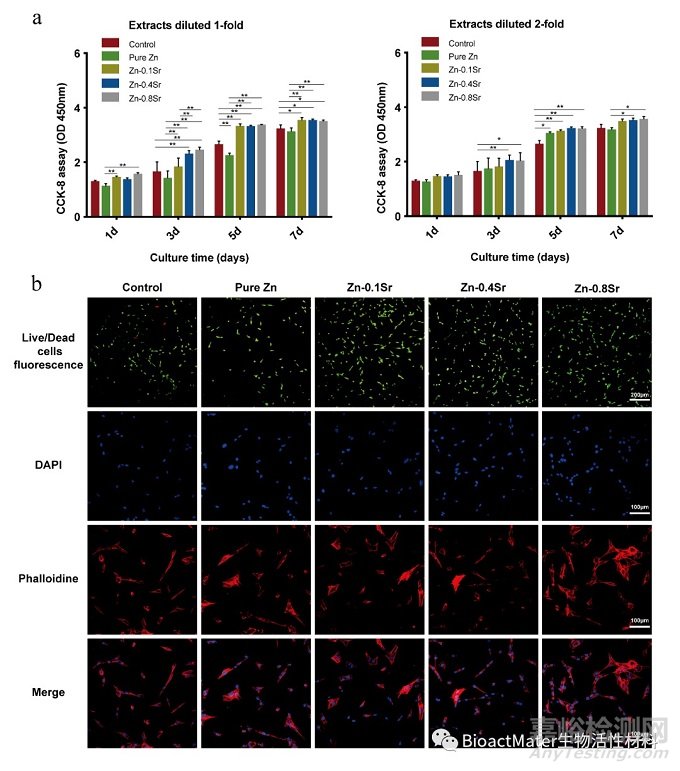
在本研究中,不同质量分数(0%,0.1%,0.4%,0.8%)的Sr被加入纯Zn中,按不同质量分数制备为纯Zn,Zn-0.1Sr合金,Zn-0.4Sr合金和Zn-0.8Sr合金。系统检测其材料表征后,首先我们对锌合金的细胞相容性表现进行了评估。我们选择CCK-8法,Live/Dead染色及细胞骨架染色评估与Zn-Sr合金浸提液共培养后MC3T3-E1细胞的增殖活性及细胞形态,结果如Figure 1所示。与纯Zn相比,Sr元素的加入有效改善了Zn-Sr合金的细胞相容性表现。
Figure 1. In vitro cytocompatibility of Zn-Sr alloys. (a) MC3T3-E1 cell activity after co-culturing for 1, 3, 5 and 7 days in pure Zn and Zn-Sr alloy extracts (one- and two-fold dilutions; mean ± standard deviation * p < 0.05; ** p < 0.01). (b) Live/dead cell staining and cytoskeletal staining of MC3T3-E1 cells cultured with pure Zn and Zn–Sr alloy extracts (one-fold dilution). Live cells were stained with green fluorescence while dead cells were stained with red fluorescence, while actin filaments were stained with phalloidin (red) and cell nuclei with DAPI (blue).
为了评估Zn-Sr合金的体外成骨活性表现,我们通过碱性磷酸酶活性染色、定量检测,成骨相关基因和蛋白(ALP, Col I, OCN, Runx-2)表达水平的检测,证实了Zn-Sr合金体外可有效促进MC3T3-E1成骨分化,具备良好的成骨活性。接下来,为了探究Zn-Sr合金发挥促成骨活性的作用机制,我们选择了Zn-0.8Sr合金,以2倍稀释的Zn-0.8Sr合金浸提液制备成骨分化诱导液诱导MC3T3-E1细胞成骨分化,12天后,收集细胞提取总RNA后行mRNA转录组测序,结果如Figure2所示。可以看到Zn-0.8Sr合金浸提液可通过促进骨的矿化,新生,骨化以及重塑,发挥成骨活性。进一步的,依据测序结果以及western-blot验证,我们发现Zn-0.8Sr合金可通过PI3K/Akt, MAPK/Erk 以及 Wnt/β-catenin通路发挥促成骨活性。

Figure 2. RNA-sequencing and western-blot results of MC3T3-E1 cells cultured for 12 days in an Zn-0.8Sr alloy extract based osteogenic medium (two-fold dilution) and blank osteogenic medium. (a) Gene expression difference. (b) Main biological functions of the up-regulated genes. (c) Quantitative validation of gene expression related to bone mineralization, bone morphogenesis, ossification and bone remodeling regulation, given as mean ± standard deviation. (*p < 0.05; ** p < 0.01). (d) Expression profile and (e) quantitative evaluation of key proteins in the PI3K/Akt, MAPK/Erk and Wnt/β-catenin signaling pathways.
为了评估Zn-Sr合金体内促成骨活性表现,我们建立了大鼠股骨髁骨缺损模型,以Zn-0.8Sr合金制备多孔支架修复骨缺损,选择纯Ti为对照组。植入大鼠体内后,于术后4周,8周,12周分别处死大鼠取材,评估大鼠股骨髁骨缺损修复情况。Micro-CT检测结果如Figure 3所示。由Figure 3可见纯Ti支架以及Zn-0.8Sr合金多孔支架的植入位置,新生骨情况以及Zn-0.8Sr合金支架体内降解情况。总的来说,随着时间的推移,新生骨量逐渐增加,且同一时间点时,Zn-0.8Sr合金支架周围新生骨量显著大于纯Ti支架。同时,Zn-0.8Sr合金支架逐渐降解,周围降解产物逐渐增加,支架体积逐渐减小。上述结果证明了Zn-0.8Sr合金体内良好的成骨特性。
Figure 3. Micro-CT results of in vivo bone defect repair. (a) Three-dimensional, sagittal, coronal, new bone and implants reconstruction micro-CT images. (b) Quantitative analyses of the osteogenesis indices, including BMD, BV/TV, Tb.N, Tb.Sp, and Tb.Th at indicate times.
完成Micro-CT扫描后,我们对大鼠股骨标本行硬组织切片染色,评价骨缺损修复情况以及局部炎症反应情况。结果如Figure 4所示。从Figure 4a,b,c可以看出,随着时间的推移,Zn-0.8Sr合金支架组新生骨逐渐增多,且较纯Ti对照组更多,同时, Zn-0.8Sr合金支架逐渐降解,这证实了Zn-0.8Sr合金良好的骨缺损修复效果,从Paragon染色(Figure 4d)中也可发现,Zn-0.8Sr合金组支架周围未见明显炎症反应,这提示了Zn-0.8Sr合金良好的局部相容性。

Figure 4. Histological analysis results. Full-view images of the bone defect areas (20×), lower magnification images (50×) and higher magnification images (100×) are arranged from left to right. (a) The Van Gieson staining results of specimens, where each row gives full-view images of bone defect areas (20×), lower magnification images (50×) and higher magnification images (100×). (b) Bone volume fraction (BV/TV) of the both pure Ti and Zn-0.8Sr alloy groups. (c) Toluidine blue staining of the pure Ti and the Zn-0.8Sr alloy groups, where the biodegradable products of the Zn-0.8Sr alloy scaffold were observed 12 weeks after surgery (red arrows). (d) Paragon staining of the pure Ti and the Zn-0.8Sr alloy groups, where desirable bone ingrowth (red arrows), normal bone tissue morphology, regenerative bone, cartilage and fat tissue (yellow arrows) were observed.
本研究设计制备了可降解Zn-Sr合金体系,并系统研究了Zn-Sr合金的材料性能,体内外生物相容性以及生物活性。证实了Zn-Sr合金良好的生物相容性,于体外阐释了Zn-Sr合金的促成骨活性并探究了其作用机制,并进一步于体内验证了Zn-0.8Sr合金支架修复骨缺损的效果。Zn-Sr合金以其理想的力学性能,适宜的降解速率,良好的生物相容性以及生物活性,有望成为骨修复材料的一种全新选择,尤其适用于临界性大段骨缺损或承重部位骨缺损的修复。
02、通讯作者简介
第一作者贾博博士
上海市第一人民医院住院医师,博士。研究方向为骨关节相关感染及并发症的诊治、可降解金属基础与临床转化研究。
通讯作者戴尅戎院士
中国工程院院士,法国国家医学科学院外籍通信院士。先后担任上海第二医科大学(现上海交通大学医学院)附属第九人民医院终身教授、骨科主任、院长,现任上海市创伤骨科与骨关节疾病临床医学中心首席科学家、数字医学临床转化教育部工程研究中心主任、上海交通大学医学3D打印创新研究中心主任、上海交通大学转化医学研究院干细胞与再生医学转化基地主任。戴院士曾先后担任世界华裔骨科学会会长、亚洲太平洋人工关节学会秘书长、会长、国际内固定学会理事及中国分会主席、国际多学科生物材料学会副主席、中华骨科学会副主任委员、上海骨科学会主任委员、中国医疗器械行业协会3D打印医疗器械专业委员会理会长兼团体标准化技术委员会主任委员、上海康复医学工程研究会理事长等30余个国际、国内学术团体的领导职务。并先后任医用生物力学、中华骨科杂志、中华外科杂志、中华创伤杂志英文版、临床骨科杂志、中国骨质疏松杂志、中国关节外科杂志、Journal of Orthopaedic Surgery、Journal of Orthopaedic Translation等34本杂志的主编、副主编、编委、顾问。发表论文500余篇,主编、参编专著59本。先后培养硕士29名、博士79名、博士后12名。戴尅戎院士先后获国家发明二等奖、国家科技进步奖二、三等奖和部、市级一、二、三等奖46项。并曾荣获首届上海市发明家、“97”香港杰出中国访问学人、上海市医学荣誉奖、何梁何利基金科学与技术奖、上海市科技功臣、吴阶平医学奖、上海医学发展终身成就奖等荣誉称号。2002年经法国外交部与卫生部批准,被授予地中海大学荣誉博士称号,是获得该殊荣的首位亚洲人。
共同通讯作者郑玉峰教授
北京大学工学院材料科学与工程系教授、博士生导师,教育部长江学者特聘教授(2016),科技部中青年科技创新领军人才(2017),中组部万人计划入选者(2019),美国医学与生物工程研究院(AIBME) Fellow(2019)。学术研究方向为新型生物医用金属材料与器械。作为项目负责人主持十三五国家重点研发计划、国家杰出青年科学基金(2012)、国家自然科学基金重点项目等40 余项,出版英文专著2本,中文专著6本,发表英文SCI论文500余篇,被引用18500余次,H-index为71,获授权发明专利30余项。社会兼职包括Bioactive Materials主编、Materials Letters编辑、Journal of Materials Science & Technology副主编、中国生物材料学会医用金属分会主任委员、中国生物材料学会青年委员会主任委员等。
03、资助信息
该研究得到了国家自然科学基金(51931001)项目的支持。
04、原文信息
Jia Bo#, Yang Hongtao#, Zhang Zechuan#, Qu Xinhua, Jia Xiufeng, Wu Qiang, Han Yu, Zheng Yufeng*, Dai Kerong*;
Biodegradable Zn–Sr alloy for bone regeneration in rat femoral condyle defect model: In vitro and in vivo studies,
Bioactive Materials, 6 (2021) 1588-1604.