您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-04-20 10:52
明胶作为生物医用材料具有生物相容性、低免疫原性、生物降解性和易操作性等优点。近年来,各种明胶微球(GMS)的制备技术不断创新,成为药物、遗传物质和有益细菌的缓释载体。此外,GMS在组织工程和再生医学中作为细胞载体和三维支架材料具有广阔的应用前景,具有良好的可注射性。通过这篇文章我们来学习一下,近年来GMS的制备方法,在生物医药上的应用进展(见图1)及今后的研究方向。
随着生物医学、材料科学、药学等基础研究的迅速发展,人类对再生医学以及癌症、栓塞、炎症等疾病的发病机制有了更深入的认识。现已经开发出一系列针对不同部位的药物递送系统,微球(microspheres)是指药物分散或被吸附在高分子聚合物基质中而形成的微小球状实体,其粒径一般在1-250μm之间,已逐渐成为新型药物释放系统的必要组成部分。微球制剂具有长效缓控释或靶向作用,可以大大提升患者用药的方便性、依从性。同时,为了满足组织工程和再生医学对细胞载体和支架的新要求,微球从小到大,从固体到空心多孔结构都表现出了显著的多功能性。之前的研究表明,GMSs不仅可以为细胞的生长和增殖创造丰富的界面,而且可以使营养物质和各种趋化因子扩散,同时微球可以与增殖的细胞整合成一个整体结构。另外,可注射性是微球的一个重要优点,可以很容易地植入患者体内,以治疗各种不同部位疾病。
明胶是一种天然聚合物,是胶原部分水解后的产物。由于其良好的生物相容性、适当的生物降解性、无毒性和非抗原性,明胶基球体在生物医学方面得到了广泛的应用。例如,物理交联的GMS已被用作制备多孔水凝胶的成孔剂;由此产生的空腔不仅为细胞生长提供空间,而且增强水凝胶的渗透性,促进细胞增殖和新组织形成。此外,物理交联的GMS可以作为细胞传递的牺牲载体。由明胶和其他天然或合成聚合物制备的化学交联GMS也表现出理想的性能,用于支架,生物活性因子和抗癌药物,肿瘤栓塞,胶囊壳,组织工程中的三维支架系统。此外,为了促进细胞生长以及药物和生物因子的扩散,已经开发了多孔GMS以增强组织工程中的细胞增殖,并为药物和因子提供新的给药释放系统。
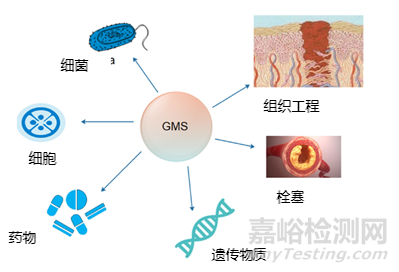
图1 明胶微球的生物医学应用
1 明胶微球的制备
GMS的制备方法主要包括乳化交联、电喷雾、喷雾干燥和微流控乳化等方法。其中,乳化交联是制备GMSs研究最多的方法。该方法首先在搅拌下将溶解于水中的明胶溶液倒入油相中,然后通过在冰浴中冷却(物理交联)和/或使用化学试剂(例如1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS))交联,甘氨酰氧基丙基三甲氧基硅烷(GPTMS)、戊二醛和京尼平(见图2)。化学交联不仅提高了GMSs的热稳定性,而且提高了GMSs的力学性能。对于乳化交联形成的GMS,可通过调整有机溶剂和表面活性剂以及油的种类和浓度、搅拌速度等制备条件,将其粒径从10μm调整到400μm。乳化交联法是一种低成本的GMS制备方法,同时所制备的GMS粒径分布小。但该方法仍存在一些不足之处,例如难以扩大到产业规模。此外,应彻底清除GMS中的残余油、交联剂和表面活性剂,否则会对细胞和组织造成毒性。
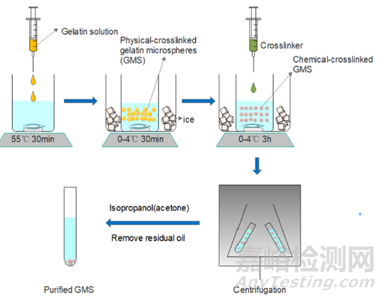
图2 乳化交联法制备GMS的示意图
制备GMS的另一种方法电喷雾(图4),是基于类似的静电纺丝原理。微球的大小可以通过改变设置参数来调整,例如电压、注入速度、针头大小和接地导电表面。将正电荷或负电荷施加到针或收集基板上以产生几千伏(kV)的电位差,从而在针的孔口处形成泰勒锥。在单轴(单针)喷涂中,所有喷涂成分将在整个过程中混合。同样,在电喷雾中泰勒锥形成射流的过程中,参数的变化会导致射流破碎成液滴,从而产生不同大小和形状的颗粒。通过电喷雾获得的微球具有较高的负载效率,不需要表面活性剂处理。在多轴喷雾中,单一溶液在进入泰勒锥之前不会混合。因此,可以制备核壳微球。
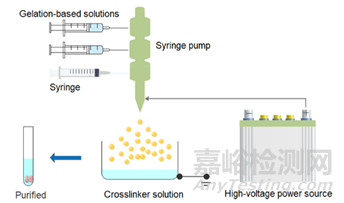
图3电喷雾法制备GMS的示意图
喷雾干燥是通过在高温气体介质中雾化喷雾将溶液、悬浮液或乳液转化为干粉的过程。主要用于食品和制药行业(见图4)。这种技术可以处理大量的溶液,而且相对便捷。明胶对温度敏感,因此温度控制是影响GMS形成的关键因素。使用Buchi B-90纳米喷雾干燥器可以很容易地制备直径为5–15μm的GMS。喷雾干燥技术已用于制备具有特定粒径的微球,用于胰岛素等药物的肺部给药。此外,微球的形成还受到工艺参数的影响,包括进风温度、聚合物浓度、表面活性剂、交联剂、出口温度、雾化压力、风量、进液速率等。近年来,随着医学对纳米封装技术的需求,纳米喷雾干燥技术已经发展成为实现纳米级药物制备的一种手段。纳米喷雾干燥法可制备纳米级超细粉体,并可大量生产。纳米喷雾干燥与超雾化相结合是一种很有前途的技术,可以产生具有精确颗粒特性的GMS。该方法制备的GMS具有球形均匀、包封率高等特点。
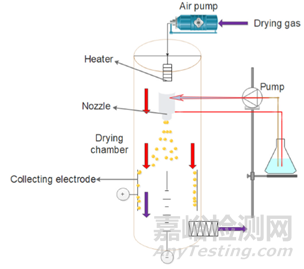
图4 喷雾干燥制备GMS示意图
微流控技术由于不需要专门的设备而越来越广泛地应用于GMS的制备。它可以产生具有广泛粒径范围(20–1100μm)的均匀GMS。此外,近年来有学者将微流控技术与3D打印技术相结合,利用注射泵、收集容器、聚二甲基硅氧烷微流控装置制备出均匀的微球。
2 明胶微球在生物医药的应用
2.1 细胞的传递和培养
微胶囊技术是一种快速发展的技术,能够将细胞包封成微球(见图5)。在先前的研究中,我们发现负载克隆小鼠颅骨前成骨细胞(MC3T3-E1)的GMS,细胞在GMS之间的空隙中快速增殖。在另一项研究中,作者用可降解的载有成骨蛋白-2(BMP2)的GMS培养MC3T3-E1细胞。两项研究都表明GMSs能增强ATP活性和新骨形成。此外,GMSs被用于MC3T3-E1的递送以修复颅骨缺损,研究结果发现负载MC3T3-E1的GMSs可以促进细胞的增殖、分化和骨再生。降解的GMS促进氧气和营养物质渗透到细胞聚集体中,改善细胞存活、增殖以及分化。此外,一项研究表明,巨噬细胞可以介导GMSs的降解,并且可以时空控制GMSs负载的BMP2的释放,进而促进间充质干细胞(MSC)成骨。通过注射实现受损组织的修复,GMS载体不仅可以提供细胞粘附界面,还可以防止细胞丢失。Nicola等人的研究结果表明,GMS对体外共培养的L929成纤维细胞无明显的细胞毒性,同时,细胞在GMS上粘附并增殖。GMSs释放的细胞可以在组织培养皿上再次定居和增殖,这一现象证明了GMSs细胞复合物在体内有助于伤口愈合的可能性。负载生长因子的GMS -透明质酸半互穿网络水凝胶在体外和体内促进MSC和鼻软骨细胞(NC)的生长和软骨细胞分化。2019年,Shirin等人将大鼠胚胎成肌细胞系(H9C2)包埋到海藻酸钠明胶微球中,H9C2不仅表现出高活力,而且保持了多功能性。
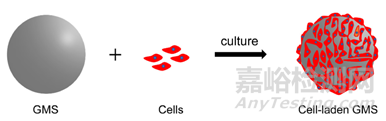
图5 GMS负载细胞示意图
近年来,GMSs与3D细胞支架的联合应用越来越受到人们的关注,GMSs作为细胞或生长因子的载体。在之前的研究中,我们将软骨细胞包裹在物理交联的GMSs中,然后将其植入海藻酸钠水凝胶中修复软骨缺损。GMS作为软骨细胞的运输载体,为软骨细胞的增殖和ECM生成创造了生存空间。在一项研究中,将人骨髓结构细胞(hBMSCs)包埋到GMS中,然后将负载细胞的GMS组装到聚己内酯(PCL)软骨支架中再生。
2.2 药物和生物活性因子的传递
GMS作为药物和生物活性因子(BFs)的载体越来越受到重视(图6)。它们可以提高其生物利用度和稳定性,实现靶向给药到特定的身体部位,并延长或控制释放。此外,药物的缓释将减少其副作用,特别是对化疗药物的副作用。因此,研究学者们研究了一系列嵌入GMS的药物来治疗多种疾病。例如,最近的一项研究表明,载头孢喹肟的GMS在靶组织中最大程度地释放药物,正常组织损伤自然消失。负载万古霉素的GMS也显示出良好的持续释放性能和对金黄色葡萄球菌(革兰氏阳性)的抗菌活性。癌症的治疗一直是人类关注的问题,而化疗仍然是最有效的治疗方法。然而,传统的给药方法仍存在许多缺点,如副作用大。为了减少抗癌药物的副作用,具有降解性能的GMS被用作肿瘤治疗的药物载体。采用乳液交联法制备了5-氟尿嘧啶磁性微球(5-Fu/MGMS)。实验结果表明,复合GMSs具有良好的性能,在体外具有缓释作用,在生理条件下具有良好的自愈能力。同样,顺铂(CDDP)是治疗胃肠道和妇科癌症最有效的药物之一,负载CDDP的GMS用于治疗腹膜癌,减少药物损失和副作用。它们显著降低了体重减轻,肾毒性和血液毒性等副作用。用GMS构建物治疗的小鼠比用游离CDDP治疗的小鼠寿命更长,用GMS构建物治疗的小鼠体重没有减轻,而用游离CDDP治疗的小鼠体重减轻了约20%。与单用顺铂或对照组相比,载顺铂GMS可延长抗癌作用。卵巢癌是常见的妇科肿瘤,晚期卵巢癌患者有一定的复发概率,部分原因是腹腔接触化疗药物时间有限。将紫杉醇纳米混悬液负载于平均粒径为283.7±1.2nm的京尼平明胶微球(PTXnano-GP-MS)可用于治疗永久性癌病,并预防疾病复发。PTXnano-GP-MS显示出优越的抗癌效果,降低了腹膜癌变指数和腹水发生率。此外,还研究了姜黄素明胶/丝纤维素微球对碘乙酸钠(MIA)诱导的骨关节炎(OA)的治疗作用,复合微球的包封率可达55-59%。结果表明姜黄素微球对大鼠OA关节有潜在的抗炎作用,且微胶囊技术和粘膜粘附材料的使用可以提高姜黄素的释放和生物利用度。
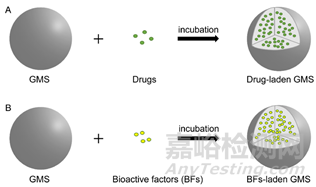
图6 载入药物(A)和生物活性因子(BFs) (B)的示意图
另一方面,关于GMS作为BFs载体的各种研究也有报道,其中BFs(如酶、生长因子、白细胞介素)具有多种功能,如促进组织再生、建立实验动物模型等。GMS已被用作输送不同生长因子的治疗剂,包括但不限于成纤维细胞生长因子(FGF)、BMP2、血管内皮生长因子(VEGF)、转化生长因子-β1(TGF-β1)。为了负载BFs,通常在BFs溶液中对GMS进行连续搅拌,然后通过快速过滤收集含有BFs的GMS,洗涤,最后冷冻干燥。研究表明,视网膜下植入含有bFGF4和IFNβ的GMS可使兔眼增殖性玻璃体视网膜病变修复。碱性成纤维细胞生长因子(bFGF)也被成功植入10μm的GMSs中修复面神经。另一项研究表明,含有降钙素基因相关肽(CGRP)的GMSs在兔骨质疏松性骨缺损模型中有效地促进了成骨。由于创伤部位的炎症和金属卟啉(MMP)酶的活性,伤口不能在短时间内愈合,为了解决这个问题,Giriprasath等人设计了用负载铁的GMS浸渍的胶原(Col)支架,提高了伤口愈合效率。此外,Tajima等人将被认为是成骨因子之一的BMP2结合到GMSs中,以促进细胞增殖和骨再生。
通过给大鼠脑卒中模型注射骨桥蛋白研究,发现将骨桥蛋白负装于GMSs后,其释放时间明显延长,MCAO梗死面积缩小,治疗窗延长。Antonio等人评价了GMSs对心力衰竭模型中VEGF和IGF-1释放的影响,GMSs双重输送VEGF和IGF-1改善了左心室的收缩和舒张功能,促进了成熟血管的形成。由葡聚糖和明胶制成的GMS被用于输送IGF-1,以促进牙周缺损处的新骨形成。
2.3 基因和细菌的传递
近年来,基因和RNA干扰治疗受到越来越多的关注。DNA是一种聚阴离子大分子,可以静电固定在阳离子化明胶上形成静电络合物。质粒DNA转入细胞后,可能编码一种维持高活性的治疗蛋白。因此,许多学者认为将DNA包埋在微球上可以实现蛋白质的释放。一些研究发现,质粒DNA随着GMS的降解而缓慢释放,从而延长释放时间。质粒DNA也被负载到纳米球中,被内化到细胞中,随着时间的推移降解以释放质粒DNA。一项研究表明,负载阳离子化明胶和BMP2质粒的支架可显著促进体内骨形成。制备阳离子化GMSs,将NK4质粒注入荷瘤小鼠体内,评价其抗肿瘤作用,结果表明,GMSs控释可增强NK4质粒的抗肿瘤作用。此外,表达VEGF的小干扰RNA(siRNA)的质粒被嵌入GMSs中,GMSs-DNA复合物在体内可抑制肿瘤生长。此外,GMSs在基因和siRNA的口服给药方面也显示出巨大的优势。
并非所有细菌都对人体有害;例如,乳酸杆菌菌株是最广泛使用的口服益生菌,可改善胃肠(GI)功能和宿主健康。基于GMS的微囊化技术是一种很有前途的口服乳酸菌保护技术。GMS能够保留细菌细胞,在特定条件下控制释放。此外,微球的粒径宜小于100μm,以减少副作用。越来越多的学者开始选择明胶微球作为细菌载体。2016年,Hansen等人开发了转谷氨酰胺酶(TGase)交联GMS作为乳酸菌的运载工具;GMS可在连续暴露60分钟内保护负载的乳酸菌免受模拟胃液(pH 2.0,37℃)的影响。同时,也可以提高乳酸杆菌在模拟肠液(ph7.4,37℃)中的存活率。以明胶和海藻酸钠为原料,对枯草芽孢杆菌SL-13进行包埋,制备新型杀菌剂。结果表明,负载的SL-13在25℃下储存120天后仍保持高活性。
4结论和未来展望
GMS作为生物医药应用中的运载工具,经历了快速的发展。GMS不仅可以为细胞的粘附、增殖和分化提供高密度的界面,还可以作为支架材料,形成新组织形成的宏观结构。这些发现大大扩展了它们在组织工程中的应用。此外,GMSs作为药物和BFs的载体,可以保护它们免受胃肠道酸和酶降解等环境胁迫。在过去的几年中,GMSs取得了巨大的进展,但仍有一些关键问题有待解决,如开发生物相容性细胞包埋方法、控制其降解特性等。明胶和海藻酸钠的联合使用以及在CaCl2溶液中的快速凝胶化可以保持较高的细胞活力,但随后的交联过程往往会引起细胞毒性。因此,探索理想的交联剂已成为开发生物相容性细胞包封策略的关键步骤。GMSs的降解不仅会影响细胞增殖,而且会影响载药和BFs的释放。通过调节交联剂的降解,可以控制GMS的降解规律。综上所述,开发合适的交联剂对于制备细胞包封的GMS和制备降解速率可控的GMS具有重要意义。此外,在GMS内形成孔隙应是调整其降解曲线的另一种策略;同时,大量孔隙的建立可增强GMS载体的渗透性。此外,利用三维生物打印技术可以控制组织工程支架中GMS或载细胞GMS的大小和三维位置,这对组织工程复合组织的形成具有重要意义。

来源:药事纵横


