您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-06 20:28
低分子量肝素类药品存在免疫原性并易引发HIT,目前已上市未经大量临床试验验证的仿制品,尚无足够证据证明其精准复制原研药品,这意味着其潜在的HIT风险难以预知和控制,故而在此呼吁,LMWHs原研药的仿制品替代存在的安全隐患,应该引起行业足够重视。
低分子量肝素(low-molecular-weight heparins,LMWHs)是临床上重要的抗凝药物,属于间接凝血酶抑制剂,它主要通过抑制凝血因子Ⅹa和Ⅱa发挥预防和治疗血栓的作用。根据米内网的医院终端数据,2019年LMWHs医院市场规模为96亿元。
肝素是从哺乳动物组织中提取的一种高度硫酸化糖胺聚糖,平均分子质量约为15000Da。而LMWHs是以肝素为原料,采用不同降解工艺生产得到的一系列复杂寡糖组成的混合物,相对分子质量通常为4000-8000Da。相较于肝素(UFH)因分子量个体差异大,需要频繁监测和滴定给药,半衰期2h左右。
LMWHs可以可靠地基于体重给药,除了一些特殊患者(老年患者、孕妇、肾功能不全患者),无需频繁监测,半衰期6~8h,因而目前主要用于长效抗凝药物的停药后桥接治疗。桥接可以作为应用长效抗血栓药物患者接受有创操作前的一个替代治疗,其目的是增强抗血栓药物的可控性,在减小高危患者围手术期血栓栓塞风险的同时,尽量最小化大手术后的出血风险。
作为临床必需用药,低分子量肝素的使用范围非常广泛,低分子量肝素广泛应用于静脉血栓栓塞症(VTE)的治疗、术后血栓风险预防、经皮冠状动脉介入(PCI)治疗和血液透析患者的抗凝等。
低分子量肝素常常以首推初始抗凝药物被诸多临床指南和共识收录,仅2020年就进入了《2020基层心血管综合管理实践指南》《2020抗血栓药物围手术期管理多学科专家共识》《2020NCCN临床实践指南:癌症相关性静脉血栓栓塞性疾病》和《2020剖宫产术后血栓栓塞症预防指南》等十多个指南、共识。这么普遍使用的药物,其实是一种复杂制剂。
低分子量肝素是动物来源的复杂制剂
这要从低分子量肝素的来源说起,低分子量肝素是以猪肠黏膜来源的肝素为原料,采用不同的解聚方法制得的,由未被完全定性的一系列复杂寡糖组成的混合物。
LMWHs的生产工艺主要包括物理法、生物酶解法和化学裂解法。物理法低分子片段取得率很低,而生物酶解法肝素酶的成本较高,一般工业化生产主要采用化学裂解法,使肝素的糖苷键发生断裂从而得到LMWHs。
按照原料来源、生产工艺和末端结构的不同,LMWHs可分为不同种类。不同通用名称的LMWHs,其相对分子质量及其分布、硫酸化程度和抗凝活性等特性指标均不相同。
欧洲药典(EP)目前收载了5种LMWHs,分别为:依诺肝素(Enoxaparin)、达肝素(Dalteparin)、那屈肝素(Nadroparin)、帕肝素(Parnaparin)和汀肝素(Tinzaparin)。
国内已上市的低分子量肝素,只有那屈肝素、达肝素钠、依诺肝素以及其他没有区分具体分子量统一命名的“低分子量肝素”。2020年版《中国药典》收录了肝素钙及注射液、肝素钠及乳膏和注射液。低分子量肝素(含那屈肝素、达肝素钠、依诺肝素)并未被列入2020年版《中国药典》,虽然此前的2017年,那屈肝素、达肝素钠、依诺肝素曾被国家药典委员会公告拟收载入《中国药典》2015年版第一增补本。
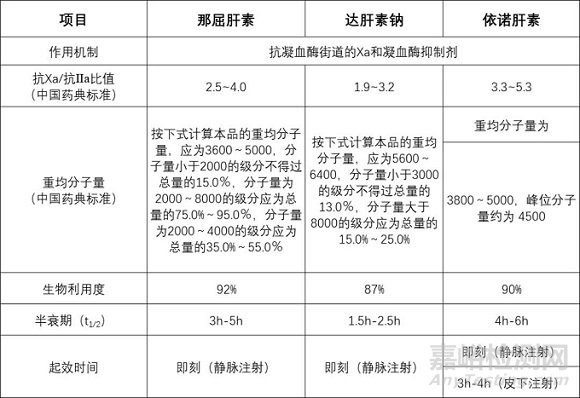
无论哪种生产工艺,最终得到的都是不同多糖链混合物,而不是单一化合物,其组成、分子量以及结构高度依赖于生产工艺。如下表所示,那屈肝素、达肝素钠、依诺肝素的重均分子量和抗Xa/抗Ⅱa比值的范围有所不同。
由于LMWHs不是单一的化合物,其很多特性指标,如相对分子质量分布、效价等,存在一定的批间变异,且LMWHs通常极性强、结构复杂,即便结合多种分析手段也难以较精细地表征其活性成分的全面一致性或相似性。然而,当前分析技术的局限性意味着绝大多数低分子量肝素的多糖链无法表征(尤其是对生产工艺敏感并产生某些药理学特性的长链)。
目前低分子量肝素的构效关系尚不完全清楚,尚未完全阐明导致每种不同的低分子量肝素对应的特定临床特征的各种机制。鉴于此,权威机构建议,不同的LMWHs不可以互换使用,譬如美国FDA早在1993年就提到不同的低分子量肝素品种不能互换使用;国际心脏论坛(ICF)指南提到“虽然低分子肝素在许多方面相似,分子结构的差异导致与其相关的抗Xa/IIa比值以及药效学的不同,这些化合物应该被判断为不同的治疗药物”。
但是如上文所说的,我国已上市的以“低分子量肝素”命名的注射剂已有24个,这些已上市的低分子量肝素注射剂应该根据抗Xa/抗Ⅱa比值和重均分子量重新定义命名,不应该统一为“低分子量肝素”。
如果仿制药/生物类似药和原研药使用相同的非专利名称,可能导致不良反应的溯源性较差。通过通用名加后缀名称的区分,可以快速发现和评价某个仿制产品特定的安全性问题。因为不同厂家生产的同一种LMWHs产品,其相对分子质量及其分布、硫酸化程度和抗凝活性等特性指标均不可能完全相同,即便是同一个名称且疗效相似,但从本质上说并不是一个物质。
2017年,美国FDA颁布指南要求仿制药企业的生物类似药必须在非专有名中添加四个字母的后缀进行区分,就是因为共享通用名无法进行产品特定溯源。出于确保对生物药品的安全性进行准确和可靠地监督及溯源的需要,FDA建议改进产品命名机制,例如给出相关但可区分的非专利名称。
低分子量肝素在我国以复杂化合物管理
低分子量肝素(含那屈肝素、达肝素钠、依诺肝素)在我国是以化学药品上市且管理的,相应的原料药也在化学药品的原料药、药用辅料和药包材登记信息中公示。
但是低分子量肝素的成分复杂,国内产品质量标准较低且单靠质量标准难以全面反映产品质量,导致我国药监部门将低分子量肝素作为“多组分生化注射液”进行管理,多组分生化注射液和中药注射剂在我国一直是以高风险药品进行重点监管。
由于动物来源的复杂成分,LMWHs类产品通常从源头开始进行全程的严格控制,包括对于动物的饲养环境、动物的来源、种属、检疫的控制、必要的病毒灭活和去除工艺验证,还可能需要根据情况,进行异常毒性、降压物质等特殊项目的检验。
2020年版《中国药典》对于生物活性测定法选的“1208肝素生物测定法”增加了新方法,为“肝素生物测定法新增抗Ⅱa因子/抗Xa因子效价测定法”,利用肝素和抗凝血酶结合形成的复合物对Ⅱa因子/Xa因子的抑制作用,引起过剩因子与生色底物反应显色的原理,测定肝素效价。
目前和中国一样,将低分子量肝素作为复杂化合物管理的还有美国FDA。FDA认为复杂化学药产品包括:①复杂的活性成分[例如肽、高分子化合物、原料药(API)的复杂混合物、天然来源的成分]。②复杂的配方(例如脂质体、胶体)。③复杂的递送途径(局部作用药物,例如皮肤病产品和复杂的眼科产品以及耳用制剂,可配制成悬浮液、乳剂或凝胶剂)。④复杂剂型(例如透皮药、定量吸入器、缓释注射剂)。⑤复杂的药品器械组合产品(例如自动注射器、定量吸入器)。其中依诺肝素属于“复杂的活性成分”类的。
美国FDA一直在升级药典对于低分子量肝素钠的检测标准,其中就有以新标准要求仪器检查项目采用氕核磁共振扩大法和阴离子交换HPLC法取代原来的CE法,磁共振1H NMR(N-acetyl at 2.16 ppm)检测保证依诺肝素不会混入多硫酸软骨素(OSCS)。
低分子量肝素是以猪肠黏膜来源的肝素为原料采用不同的解聚方法制得的,其原料的获得方式更像生物制剂——是一种从生物或其成分中提取出来的物质,可用于治疗多种疾病,包括疫苗、血液和血液成分、过敏原制剂、体细胞、基因治疗、组织和重组治疗蛋白等多种药品。因此,WHO就根据低分子量肝素的生物来源将低分子量肝素定义是生物制剂[1]。欧盟等多国也将低分子量肝素视为生物制剂管理。
这意味着低分子量肝素的仿制药,FDA是以复杂仿制药管理的,欧盟等其它国家则是以生物类似药为管理的。2020年化学药品注射剂一致性评价启动,低分子量肝素其市场规模吸引着国内已上市产品启动一致性评价或以新注册分类申报上市。
临床使用低分子量肝素需要药物警戒(PV)
临床使用中,LMWHs经常被存在发生肝素诱导的血小板减少症(heparin-induced thrombocytopenia,HIT)的风险。当机体针对LMWHs-PF4复合物产生抗体时,可能引发不可逆的血小板聚集、减少,甚至是血栓形成(heparin-induced thrombocytopenia and thrombosis, HITT),这将严重威胁患者生命安全。
血小板减少症(heparin-induced thrombocytopenia,HIT)的临床表现包括:(1)血小板下降,<100×109/L,较基础值下降幅度≥50%(需注意基线血小板计数较高的患者);(2)血栓形成,DVT、PE、动脉血栓(其中动脉血栓:静脉血栓=1:4);(3)肝素-诱导的皮损:注射部位局部出现痛性红斑或皮肤坏死;(4)急性全身反应:发热、寒战、心动过速、呼吸困难、DIC等;(5)出血罕见。
数据显示,经低分子量肝素治疗的患者发生HIT的风险为0.2%~0.4%。通常1/3~1/2的HIT患者会发生静脉、动脉或微血管血栓形成(heparin-induced thrombocytopenia and thrombosis,HITT),其中静脉血栓栓塞症的发生率最高,皮肤坏死、肢体坏死、心肌梗死、脑梗死等也时有发生。鉴于LMWHs可以在门诊患者中使用,临床应用种应重视LMWHs产品免疫原性风险的评估和管理。
LMWHs的血小板减少症(HIT)的发生,与其具有潜在免疫原性有一定相关性。并且,不同LMWHs的HIT抗体发生率和相应抗体(IgG、IgA、IgM)比例不同;不同的生物仿制药和参比制剂对HIT抗体的应答会不同。
所有生物制剂都有潜在免疫原性(来自抗体作用,取决于滴度和亲和力),并且与非生物制剂相比,具有更大的潜在免疫原性风险。在大多数情况下,生物免疫原性没有临床意义,例如抗体的短暂出现,并且不会影响产品的风险-效益平衡。但某些情况下,免疫原性可能导致严重和危及生命的反应,低分子量肝素的生物来源注定其有免疫原性,实际应用中发现低分子量肝素的免疫原性风险高,安全性低,正属于需要重点监测管理的类别。
与非生物制剂相比,生物制剂由于其性质更为复杂,具有更大的免疫原性潜在风险,因此需要对特定产品进行药物警戒和风险管理活动。此外,上市前研究的有限样本量可能不允许在上市前评估免疫原性的罕见后果,生物制剂和生物类似药的临床安全性必须在上市后阶段持续密切监测。
LMWHs的质量监管须有药物警戒(PV)的考量,要保证不良反应(AE)报告的适当性。含LMWHs药品不良反应的药物警戒监测包括已知与LMWHs相关的罕见严重不良事件,如肝素诱导性II型血小板减少症(HIT II,HITT)。
2020年9月15日CDE发布的《低分子量肝素类仿制药免疫原性研究基本技术要求(征求意见稿)》专门在第四节中对于药物临床警戒,做了说明:“产品上市后,应针对已知和潜在的安全性风险制定风险控制计划,监测低分子肝素相关的严重不良反应例如HIT和HITT,以及类过敏反应和过敏反应,并在再注册时提供安全性报告。”这意味着已上市的低分子量肝素需要一个全面的风险管理计划来处理罕见的安全事件,以确保患者的长期安全和健康。对于国内尚未通过一致性的肝素产品,理应采取更严格的监管。
低分子量肝素类的仿制/一致性评价要考虑其免疫原性
随着仿制药一致性评价工作的不断推进,越来越多的化学仿制药产品替代了原研产品,绝大部分产品获得了治疗与疗效的一致,对于降低老百姓用药负担和节省医保基金取得了显著效果,产生了巨大的社会效益。96亿元市场规模会激发生产厂家启动低分子量肝素类的仿制/一致性评价研究。
欧盟等多国对于低分子量肝素的仿制是以生物类似药为管理的,这意味着低分子量肝素类药物的上市就需要启动临床研究,临床研究包括药代动力学/药效学研究和安全性/免疫原性研究。
我国药品相关监管部门可以学习WHO,WHO对所有使用不符合当前国际监管标准的数据包许可的生物治疗产品进行逐步的监管重新评估,我国也应该对肝素类产品的监管采取类似WHO生物类似药监管途径——目前已上市的肝素类药物在一定的时间内完成免疫原性一致性研究。
从2020年CDE曾发布《低分子量肝素类仿制药免疫原性基本技术要求(征求意见稿)》可以看出,CDE认为低分子量肝素的仿制要求包括但不限于活性成分对比研究和免疫原性的评估。
活性成分对比研究的研究包括:1.所用肝素钠原料应以新鲜猪小肠为起始物料, 肝素钠原料药的质量标准应符合中国药典,肝素钠的解聚模式应与原研产品一致。2.理化性质的对比研究。3.双糖结构单元、寡糖片段分布和寡糖序列的对比研究。4.体外生物学和生物化学活性的对比研究。5.人体药效学等效性研究。
免疫原性的评估则包括:1.杂质对比研究。2.LMWHs-PF4复合物的研究。3.评估免疫原性的其他体外模型/方法。4.免疫原性临床研究。
美国FDA2020年出台依诺肝素仿制指导草案,以5项标准确定依诺肝素的“一致性”:1.物理化学性质一致;2.肝素来源、解聚方式一致;3.二糖结构单元、片段图和低聚糖类序列一致;4.生物和生化测定一致;5.体内药效学曲线一致。
《低分子量肝素类仿制药免疫原性基本技术要求(征求意见稿)》仅仅要求仿制药和参比制剂之间启动人体药效学等效性试验,如果经评估,仿制品的性质、所含杂质和赋形剂的性质不会带来免疫原性的风险或不确定性,并且开展了适当的非临床免疫原性探索性研究,也未发现免疫原性风险,可不进行专门的免疫原性临床研究。然而业界认为目前的非临床模型和分析方法/生物测定技术并不能预测人体免疫原性,这意味着低分子量肝素类仿制药上市/通过一致性评价需要进行免疫原性临床研究。
低分子量肝素类的仿制替代应慎重
从病人获益和节省治疗费用的角度出发,在进行原研药的仿制品替代时,要考虑到负责药物制剂,特别是像肝素这类具有潜在免疫原性的药品,建议避免“一刀切”政策带来临床用药风险,进而妨碍仿制药替代工作的顺利进行。
低分子量肝素类目前只有一家通过一致性评价,未达到国家集中采购带量的充分竞争的最少要三家通过一致性评价(含原研参比制剂和视同通过一致性评价)的要求,但是96亿元的市场规模会推动省级带量采购,从而实现仿制替代。
值得注意的是,LMWHs类药品存在免疫原性并易引发HIT,目前已上市未经大量临床试验验证的仿制品,尚无足够证据证明其精准复制原研药品,这意味着其潜在的HIT风险难以预知和控制,故而在此呼吁,LMWHs原研药的仿制品替代存在的安全隐患,应该引起行业足够重视。
参考文献
【1】The regulatory landscape of biosimilars: WHO efforts and progress made from 2009 to 2019 – Biologicals, available online 27 March 2020

来源:同写意


