您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-31 13:30
纤维内窥镜是供人体内腔检查和手术时用的医用光学器械。它利用人体自然腔道或切口导入人体,对预期区域或部位进行照明并于体外成像以供观察和诊查,结合手术器械可进行组织取样(活检等)。
第二类诊断用软性纤维内窥镜产品,即纤维上消化道镜、纤维结肠镜、纤维大肠镜、纤维支气管镜、纤维鼻咽喉镜、纤维胆道镜、纤维膀胱镜。其他第二类纤维内窥镜研发实验要求、相关标准与主要风险也可参考本文的内容。
诊断用软性纤维内窥镜产品的结构和组成
(1)不含导光束的纤维内窥镜
不含导光束的纤维内窥镜由头端部、插入部、操作部、目镜部或接物镜、吸引阀(仅带工作通道内窥镜适用)等组成。
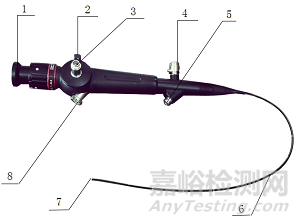
图1不含导光束的纤维内窥镜
1.目镜部或接物镜2.转动钮3.导光接头4.测漏阀
5.插钳口(无工作通道内镜不含插钳口) 6.插入部7. 头端部8. 吸引阀
(2)含有导光束的纤维内窥镜
含有导光束的纤维内窥镜有头端部、插入部、操作部、目镜部或接物镜、导光插头、吸引阀(仅带工作通道内窥镜适用)等组成。

图2含有导光束的纤维内窥镜
1.目镜部或接物镜2.转动钮3.导光接头4.测漏阀
5.插钳口(无工作通道的内窥镜不含插钳口)6.插入部7.头端部
8.吸引阀9.操作部 10.导光束
诊断用软性纤维内窥镜的研究要求
1.性能研究
开发者应当对产品性能进行研究,确认产品技术的要求,包括功能性、安全性指标。并对质量控制相关的其他指标进行确认,对所采用的标准或方法、采用的原因及理论基础进行验证。
2.生物相容性评价研究
开发者应对产品中与患者和使用者直接或间接接触的材料的生物相容性进行测试评估。具体参照《关于印发医疗器械生物学评价和审查指南的通知》(国食药监械〔2007〕345号)。
3.生物安全性研究
由于内窥镜产品不含有同种异体材料、动物源性材料或生物活性物质,本条不适用。
4.灭菌/消毒工艺研究
开发者应当对产品的消毒或灭菌工艺进行研究以确定符合标准的方法。如选用的灭菌方法容易出现残留,应当对残留物信息及采取的处理方法进行研究确认。
5.产品有效期和包装研究
开发者应对产品的有效期或使用次数进行研究。保证产品符合GB/T 14710-2009 《医用电气设备环境要求及试验方法》标准要求。
6.临床前动物试验:不适用。
7.软件研究:内窥镜为不含有软件的产品,本条不适用。
8.开发者可开展其他能够证明产品安全性、有效性的研究。
软性纤维内窥镜主要性能指标
本文给出需要考虑的产品基本技术性能指标,但并未给出定量要求,可参考相应的国家标准、行业标准,根据自身产品的技术特点制定相应的要求。涉及材料内容的应说明选用材料满足的国家标准或行业标准。以下是通常的性能指标:
1.安全性能
(1)外观(浊度、色泽):无色透明,凭目视看不出异物。
(2)酸碱度(pH):与标准试验液的pH之差为2.0以下。
(3)重金属总含量:重金属总含量<5.0μg/ml。
(4)高锰酸钾还原性物质:与标准试验液的消耗量之差为2.0mL以下。
(5)蒸发残渣:蒸发残渣<2.0mg。
2.表面安全性
(1)各连接件的粘接的连接牢固、可靠,焊接件应焊接平整、无虚焊、脱焊或堆焊。
(2)头端部及插入软管部外表面应平整、光滑、无明显的突起或者划痕、毛刺等缺陷。
3.光学系统性能
(1)光学系统基本要求
光学系统应能保证观察清晰,不得有脱胶、脱模、和粘接剂的裂纹现象,光学零件不应有影响观察的麻点、划痕、气泡、油污、霉点和灰尘等附着物。
(2)照明有效性: 边缘均匀性---在有效景深范围内检查,照明光斑应充满视场的有效尺度,且在最大视场角的90%视场处的照度应均匀,在该视场带上选择四个正交方位测试,其均匀度应满足表1的规定。
表1 边缘均匀度要求
|
标称视向角范围 |
不均匀性 |
|
θ≤30° |
≤25% |
|
30°<θ≤50° |
≤35% |
|
50°<θ |
≤45% |
(3)有效光度率: 内窥镜有效光度率的名义值为××(注册申请人自行定义),实测值应不大于名义值。
(4)分辨率: 在工作距离等于××mm时(注册申请人自行定义),分辨率不得低于××lp/mm。
(5)视度调节: 目镜的视度调节范围应不小于±3屈光度,调节操作应平稳舒适。
(6)纤维传像束的断丝数:在视场直径范围的50%内断丝数不得多于3根,且断丝数不得相邻;在视场直径范围的50%外断丝数不得多于10根,且不得有3根及以上的断丝数相邻,相邻断丝数不得多于2处。
(7)视场角: 视场角为××(注册申请人自行定义),其极限偏差为±10%。
(8)观察景深: 观察景深范围不小于XXmm—XXmm(注册申请人自行定义)。
4.吸引、钳道系统(如适用)
(1)吸引:吸引应通畅,钳子插入口处应有对人体内腔液体的防喷装置。吸液操作时,在防喷装置和吸引按钮处不应出现液体倒喷现象。
(2)吸引量:吸引量不得少于××mL/min(注册申请人自行定义)。
(3)吸引按钮:吸引按钮应掀动自如,无卡住现象。
5.弯角操纵系统
(1)弯角手轮:弯角手轮在操作时,轻便灵活,无时松时紧或卡住现象。
(2) 弯曲状态时手术器械的可操作性:当纤维弯角部弯曲成最大角度时,活检钳、圈套器等手术器械能顺利进出头端部的钳道口。
(3)弯曲角度:由注册申请人自行定义,如向上××°,向下××°,向左××°,向右××°,允差:-10%(上限不计)。
6.密封性能
(1)密封性:将内窥镜整体放入水中,其内腔能承受22kPa压强3min而不漏气。
(2)雾层:内窥镜在10℃—40℃温度范围内使用。光学零件表面不应出现受温度变化而产生影响观察的雾层。
7.与附件的配合
(1)与附件接口配合连接:纤维内窥镜与相应附件接口等连接时,应配合良好,装卸自如,无过松过紧现象;
(2)与相应附件配合使用:在工作距离处,配用的活检钳、圈套器等应能正常工作。
8.标记
(1)主软管标记:主软管上应刻有长度标记,标记的线条清晰;
(2)视场光栏标记:视场光栏必须有方向标记,从目镜看去,箭头指示方向应在上方。
(3)弯曲操作部的操作方向标记:纤维内窥镜的弯曲操作部的位置,相对弯角操作部的弯曲方向,弯角方向必须符合YY 1028-2008中4.8.3 a)、4.8.3 b)项的要求。
9.尺寸
内窥镜型号表和基本参数
|
产品型号 |
工作距离 |
工作长度 |
头端硬性部外径 |
主软管外径 |
最大插入部外径 |
最小工作孔道内径 |
|
XX |
XXmm |
XXmm, 允差±10% |
φXXmm, 允差+5%,下限不计 |
φXXmm, 允差+10%,下限不计 |
≤φXXmm |
≥φXXmm |
10.电气安全性能
纤维内窥镜电气安全应符合GB 9706.1-2007、GB 9706.19-2000的要求。
11.环境试验
纤维上消化道内窥镜应符合YY 1028-2008气候环境试验II组,机械环境试验II组和GB11244中4.10的要求。纤维大肠镜应符合YY /T 0283-2007中气候环境试验II组,机械环境试验II组和GB11244中4.10的要求。
其他纤维内窥镜的环境要求应符合GB/T14710-2009、GB 11244-2005中4.10气候环境试验I组,机械环境试验I组的要求。
诊断用软性纤维内窥镜的主要风险
1.产品自体性能可能引起的危害
(1)不符合现有标准光学性能要求:视场角、视向角(若适用)、分辨率(规定工作距时)、景深范围、成像清晰和视场质量、放大率(若适用)、断丝数、照度和视度调节(若适用)不符合现有标准(可参照GB 11244-2005、YY 1028-2008等)的要求,会产生危害。
(2)畸变:诊查和/或手术中易导致方位混淆、丢失感觉、视心理改变、判断失误等风险。
(3)传像束断丝分布和密集度:若断丝分布于诊查和/或手术主要区域--视场中心,除影响成像质量外,造成诊断和/或手术的判定错误或病变不能查觉(漏诊误诊),甚至无法工作。
(4)颜色分辨能力和色还原性不良:人体腔内颜色接近、变化细微的组织不能区分,病灶不能识别或判断错误,误诊或手术错误的风险就极大,甚至有可能发生如动脉破损大出血的立即死亡危险。
(5)照明的光斑分布和边缘均匀性不良:成像不良,临床灰阶识别困难易诊断或手术失误;受辐射区域组织局部过热,可能存在组织烘干或灼伤的潜在危险。
(6)像面边缘光强与中心光强的分布不良:操作者眼疲劳、不适而带来人为风险。腔内边缘组织无法识别诊查,腔内手术时,手术器械和内治疗设备将失去把握带来危险;或视场中心光能过大产生眩光/中心光亮饱导致关健区域失效的临床风险,同时提高光强会造成腔内中心区域多热而烘干或炽伤组织。
(7)过量辐射:直接与内窥镜出光口接触的组织过热和受照组织过热烘干或炽伤危险。
2.机械性能不良
(1)不符合现有标准机械性能要求:尺寸、表面安全性能、送水/气系统、吸引/手术通道系统、弯曲操纵系统、密封质量、附件配合性能不符合现有标准(可参照YY1028-2008)的要求,会产生危害。
(2)最大强度限:发生在诊察或手术中,弯曲操纵系统破坏,导致插入人体部分失控、或某形状下僵住、或手术孔道内器件锁死,甚至可能破坏外层胶皮而带来电击、感染、生物毒性、或直接机械损坏组织风险。
(3)金属软管耐久性:发生在诊察或手术中,插入人体部分失控、或某形状下僵住、或手术孔道内器件锁死,甚至可能破坏外层胶皮而带来电击、或感染、或生物毒性、或直接机械损坏组织风险。
(4)弯曲操控机构的耐久性:发生在诊察或手术中,插入人体部分失控或僵住或弹回损坏异形腔道,甚至可能破坏外层胶皮而带来或电击、感染、生物毒性或直接机械损坏组织风险。
(5)外胶皮的耐久性:发生在诊察或手术中,插入人体部分失控或僵住或弹回损坏异形腔道,甚至可能破坏外层胶皮而带来电击、感染或直接机械损坏组织风险。甚至有可能材质变性而具生物毒性。
(6)插入头部胶接的耐久性:发生在诊察或手术中,插入人体部分失密封而带来或电击、感染或生物毒性等危险。
3.抗腐蚀性
(1)抗腐蚀性能不良:插入人体部分失密封而带来或电击、或感染、或生物毒性等危险,或外露部分化学变化而致生物毒性。
4.生物相容性
不符合现有标准(可参照YY 1028-2008、GB/T 16886.1-2011、GB/T 16886.5-2005、GB/T 16886.10-2003系列标准)生物相容性要求:
对可用于接触患者和使用者材料的生物相容性评价,依据GB/T 16886.1-2011的评价原则。
对符合生物相容性高分子材料的生产批控制,可用材料溶出物试验证明,试验内容有:外观、pH值、重金属(Pb)、高锰酸钾还原性物质、蒸发残留物。
诊断用软性纤维内窥镜产品适用的相关标准
1.产品应适用的国家标准、行业标准
GB 9706.1-2007 医用电气设备第一部分: 安全通用要求
GB 9706.19-2000 医用电气设备第2部分: 内窥镜设备安全专用要求
GB 11244-2005 医用内窥镜及附件通用要求
YY/T 0283-2007 纤维大肠镜
YY 1028-2008 纤维上消化道内窥镜
2.可引用或参照的国际标准
ISO 8600-1-2013内窥镜医用内窥镜和内窥镜附件第1部分: 一般要求
ISO 8600-3-1997光学和光学仪器医用内窥镜及内治疗设备第3部分: 视场角和视向角的测定
ISO 8600-4-2014内窥镜医用内窥镜及内镜治疗装置第4部分:插入部分最大宽度的测定
3.可引用或参照的其他相关标准:
GB/T 191-2008 包装储运图示标志
GB/T 14710-2009 医用电气设备环境要求及试验方法
GB/T 16886.1-2011 医疗器械生物学评价第1部分: 风险管理过程中的评价与试验
GB/T 16886.5-2003 医疗器械生物学评价第5部分: 体外细胞毒性试验
GB/T 16886.10-2005 医疗器械生物学评价第10部分: 刺激与致敏反应试验
YY 0076-1992 金属制件的镀层分类技术条件
YY/T 0466-2003医疗器械用于医疗器械标签、标记和提供信息的符号
YY/T 0466.1-2009医疗器械用于医疗器械标签、标记和提供信息的符号第1部分: 通用要求

来源:嘉峪检测网


