您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-07 14:37
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:17条资讯,阅读时长约:3分钟 」
今日头条
吸入式新冠疫苗国内申请紧急使用。军事科学院陈薇院士日前透露,她带领团队与康希诺合作研发的吸入式重组腺病毒新冠疫苗正在国内申请紧急使用授权。这款疫苗与今年2月获得附条件批准上市的注射式腺病毒载体疫苗在毒种、细胞库、原液生产工艺、制剂生产工艺、制剂配方等均相同。该疫苗采用雾化吸入免疫专用设备进行接种,所需剂量仅为注射式腺病毒载体疫苗的1/5,可以形成黏膜免疫,有望降低疫苗接种的成本。
国内药讯
1.诺华心衰药国内获批治疗高血压。NMPA批准诺华重磅药Entresto(沙库巴曲缬沙坦,诺欣妥)新适应症,用于治疗原发性高血压。Entresto是由沙库巴曲与缬沙坦组成的盐复合物晶体,是首个血管紧张素受体脑啡肽酶抑制剂(ARNI)类药物,是当前唯一一款同时获批用于两种类型心衰(HFrEF和HFpEF)的药物。这是继2017年心衰适应症获批之后,Entresto在中国获批的第二个适应症。
2.百济神州PD-1单抗申报新适应症。百济神州PD-1替雷利珠单抗的新适应症上市申请获CDE受理,推测递交的适应症为拟用于MSI-H/dMMR实体瘤的治疗。公布于2021 ASCO大会上的一项Ⅱ期研究数据(NCT03736889)显示,中位随访时间为11.78个月时,IRC评估的ORR为(单侧 p<0.0001)45.9%(n=34/74;95% CI 34.3,57.9);有71.6%的患者获得疾病控制,有52.7%的患者在 IRC≥24周达到CR、PR或持久稳定疾病;DoR中位值未达到。目前,国产PD-1尚无产品获批MSI-H/dMMR适应症。
3.恒瑞治疗乳腺癌疗法III期临床成功。恒瑞医药马来酸吡咯替尼片联合曲妥珠单抗加多西他赛术前治疗早期或局部晚期HER2阳性乳腺癌的III期临床达到主要终点。研究结果表明,在多西他赛和曲妥珠单抗的基础上联用吡咯替尼的新辅助治疗能够显著提高患者的tpCR率(总体病理完全缓解)。预计这款小分子泛ErbB受体抑制剂吡咯替尼即将提交上述适应症的补充上市申请。
4.诺诚健华公布泛FGFR抑制剂临床数据。诺诚健华在ASCO2021年会上公布泛FGFR抑制剂ICP-192(gunagratinib)用于FGFR阳性晚期实体瘤的I期临床结果(摘要代码:4092)。在完成至少一次肿瘤评估的12例患者中,客观缓解率为33.3%,包括1例胆管癌患者(8.3%)达到完全缓解,3例患者(25%)达到部分缓解,7例患者达到疾病稳定。疾病控制率为91.7%。ICP-192安全性和耐受性良好,目前尚未达到最大耐受剂量(MTD)。
5.四环医美获得脂肪采集系统独家代理权。四环医药美国子公司Meiyen日前与美国Genesis Biosystems公司达成战略合作,获得其脂肪采集系统LipiVage®在大中华区(中国大陆、香港、澳门、台湾地区)及韩国的独家代理权,进一步扩充集团的医美产品管线。LipiVage®是一种创新产品,已在美国上市应用。据悉,吸脂是中国女性塑形的首选方式,中国吸脂手术在总医美消费中的占比已高于美国,2020年美体塑形中吸脂消费占比超过80%。
6.康柏西普用于早产儿视网膜病变获临床许可。康弘药业康柏西普眼用注射液获CDE临床许可,拟用于治疗l区(1期+、2期+、3期、3期+)、或2区(2期+、3期+)或AP-ROP(急进性后极部早产儿视网膜病变)的早产儿视网膜病变。康柏西普是该公司自主研发并具有完全自主知识产权的VEGF靶向生物创新药,目前已获批用于治疗湿性年龄相关性黄斑变性(nAMD),以及获批用于继发于病理性近视脉络膜新生血管引起或继发于糖尿病黄斑水肿(DME)引起的视力损害。
国际药讯
1.司美格鲁肽减肥适应症获FDA批准。诺和诺德长效GLP-1激动剂Wegovy(司美格鲁肽每周1次皮下注射2.4mg)获FDA批准上市,用于慢性体重管理,适用于伴有至少一种体重相关合并症的肥胖或超重成人。在一项IIIa期STEP研究中,与安慰剂相比,每周1次皮下注射司美格鲁肽2.4 mg治疗68周后,可以减重16%~18%;最常见的不良反应是轻微且一过性的胃肠道事件。
2.诺华放射配体疗法Ⅲ期临床结果积极。诺华将在ASCO2021年会上公布靶向放射配体疗法(RLT)177Lu-PSMA-617治疗PSMA阳性去势抵抗性前列腺癌(mCRPC)的Ⅲ期临床VISION最新结果。与最佳标准治疗(SOC)相比,177Lu-PSMA-617治疗组患者中位总生存期延长了4个月,死亡风险降低38%(HR=0.62, 95% CI:0.52,0.74),放射学疾病进展或死亡的风险也降低60%(HR=0.40,99.2% CI:0.29,0.57),但该组与治疗相关不良事件的比例高于对照组(85.3%vs28.8%)。
3.奥拉帕利治疗早期乳腺癌长期疗效积极。阿斯利康与默沙东联合开发的PARP抑制剂奥拉帕利(Lynparza)在治疗携带gBRCAm、高风险HER2-早期乳腺癌的Ⅲ期临床OlympiA中获积极结果。奥拉帕利较安慰剂将患者疾病复发、出现新肿瘤或死亡的风险降低42%(HR=0.58; 99.5% CI:0.41-0.82; p<0.0001);在接受治疗3年后,两组没有出现癌症复发或新的癌症的患者比例分别为85.9%和77.1%;此外,奥拉帕利将远端疾病复发或死亡风险降低了43%。
4.Keytruda辅助治疗早期肾细胞癌Ⅲ期结果积极。默沙东PD-1抑制剂Keytruda用于辅助治疗早期肾细胞癌(RCC)的Ⅲ期临床KEYNOTE-564结果积极。在中位随访为24.1个月时,Keytruda与安慰剂相比,在接受肾脏全部切除或者切除肾脏和转移性病灶的RCC患者中,将疾病复发或死亡风险降低32%(HR=0.68, 95% CI,0.53-0.87,p=0.0010),将死亡风险降低46%(HR=0.54,95% CI, 0.30–0.96,p=0.0164)。此前,FDA已批准Keytruda联合化疗一线治疗RCC;Keytruda联合Lenvima一线治疗RCC也获得FDA的优先审评资格。
5.阿斯利康PD-L1疗法特定肺癌患者5年生存率43%。阿斯利康(AstraZeneca)重磅PD-L1抑制剂Imfinzi(durvalumab)在治疗III期非小细胞肺癌(NSCLC)的Ⅲ期临床PACIFIC获长期疗效。放化疗后(CRT)疾病没有进展的III期不可切除的NSCLC患者接受了Imfinzi或安慰剂的治疗。接受Imfinzi治疗的患者的5年生存率估计为42.9%,而安慰剂组为33.4%。Imfinzi组的中位总生存期为47.5个月,而安慰剂组为29.1个月。详细结果于ASCO2021年会上公布。
6.罗氏脊髓性肌萎缩症药物在英被拒。英国国家健康与护理卓越研究所(NICE)针对罗氏口服脊髓性肌萎缩症 (SMA) 药物Evrysdi(risdiplam)发布指南草案,不建议使用Evrysdi用于1、2和3型SMA患者。NICE认为Evrysdi的长期效益不确定,成本太高。NICE目前推荐渤健的Spinraza用于症状前的SMA患者或1、2或3型疾病的患者;以及推荐诺华的基因疗法Zolgensma,为12个月以下患有1型SMA的婴儿提供每剂179万英镑的治疗。
7.Stablix公司拟开发蛋白稳定疗法。Stablix Therapeutics完成6300万美元A轮融资,旨在利用其独特的RESTORED技术平台,开发靶向增加蛋白质稳定性的创新疗法。过度泛素化也是许多癌症的特征之一,添加泛素标签的E3连接酶表达水平的升高可能导致具有抑癌作用的蛋白的降解。RESTORED平台开发的双特异性功能的小分子,可以将去泛素化酶(deubiquitinase)募集到目标蛋白的附近,去除目标蛋白上的泛素,从而稳定或增加目标蛋白的水平和活性。
医药热点
1.惠民保监管新规出台。银保监会发布《关于规范保险公司城市定制型商业医疗保险业务的通知》,鼓励保险公司以城市为单位,将医保目录外医疗费用、健康管理服务纳入保障范围,为城市居民提供类医保产品惠民保的保障服务。该《通知》的发布意味着惠民保迎来明确的监管,原先有诸多不规范的发展问题也将得到纠正。
2.美国公布首批新冠疫苗全球分配计划。美国3日公布了首批2500万剂新冠疫苗全球分配计划。美国将通过世卫组织主导的“新冠肺炎疫苗实施计划”分享首批疫苗中的近1900万剂,其中约600万剂将提供给拉丁美洲和加勒比地区,约700万剂将提供给南亚和东南亚地区,约500万剂提供给非洲地区。其余600多万剂疫苗将直接提供给疫情较严重的国家,包括加拿大、墨西哥、印度、韩国等。
3.广州猎鹰号气膜方舱实验室启用。国家呼吸系统疾病临床医学研究中心、呼吸疾病国家重点实验室、广州医科大学第一附属医院、广州呼吸健康研究院等单位共建的联合“猎鹰号”方舱实验室,6月1日在广州首次投入使用,以提高广州市及周边地区的核酸检测能力。此次在广州体育馆搭建的4组气膜实验室,其日检测产能可超12万管。
审评动向
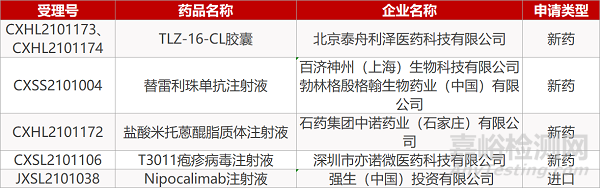
1. CDE新药受理情况(06月06日)
申请临床:
北京泰舟利泽的TLZ-16-CL胶囊(2个规格)、石药集团中诺药业的盐酸米托蒽醌脂质体注射液、深圳市亦诺微医药的T3011疱疹病毒注射液、 强生的Nipocalimab注射液。
申请生产:
百济神州/勃林格殷格翰的替雷利珠单抗注射液。
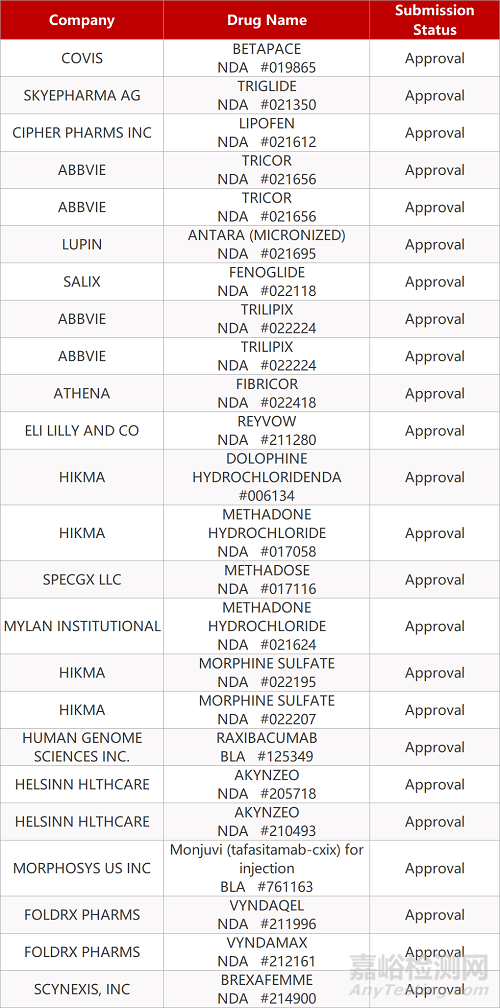
2. FDA新药获批情况(北美06月04日)

来源:药研发


