您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-09 13:01
根据药物的溶解度和渗透性情况,把药物划分成四个象限,即BCS分类系统。根据药物所属象限情况,我们可以制定不同的制剂策略,比如BCS Ⅱ类药物难溶解易渗透,渗透性已经满足体内暴露量的要求,奈何溶解度成为了药物开发的拦路虎,绊脚石。当然,可以根据药物的溶解度特点,可以制定不同的增溶策略。
一个化合物的溶解,一般由以下三个过程构成:(一)药物加入到溶剂中,根据化合物的可润湿性(一般化合物润湿角小于90°,化合物易于润湿。),化合物被溶剂所润湿。(二)润湿的化合物晶体(化合物多以结晶结构存在,故而溶解度研究的起点从药物晶型开始。药物分子的堆积方式的不同,堆积分子与溶剂间作用力亦不相同,进而造成多晶型药物溶解度的差异,故而需要在晶型研究中,关注多晶型药物对于溶解度的影响。当此种影响对制剂的溶出带来影响,会进而会影响到药物的生物利用度以及疗效,需要对晶型建立质量标准或者严格控制制剂中药物的晶型,保证其稳定性。)需要打破药物分子之间的结合力,即打破晶体结构,与溶剂分子“水乳交融”。根据化合物分子的大小(分子的大小与分子量有关),需要在溶剂中形成一个空腔,化合物分子即溶剂化。分子越大,形成的空腔越大,需要的能量也就越多。(三)脱离“组织”的化合物分子通过一系列的作用力与溶剂发生作用,这个过程,一般与化合物的LogP有关,根据相似相溶原理,亲水性越强,化合物越能溶解。一般要求化合物LogP在1~3之间,亲水性与疏水性达到平衡,既不很影响溶解,也不造成化合物难以渗透进入血液循环。经历以上三个过程,化合物达到了溶解状态。当然对于平衡溶解度的测定,化合物在溶剂中的溶解与析出是处于动态平衡。
化合物溶解经历三个过程,且任何一个过程都可能成为整个溶解过程的限速步骤。
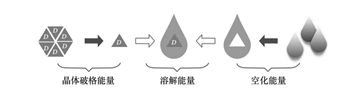
晶体药物溶解的原理
针对化合物难以被润湿,可以通过加入表面活性剂,表面活性剂具有两亲性结构,疏水段吸附于化合物,亲水端朝向溶剂(一般为水性介质),改变化合物表面特征,也降低液体表面张力,进而使化合物的润湿性得到提高。
针对化合物晶格结构比较稳固的特点,即晶格能比较高,需要打破晶格能才能解决其难溶的问题。一般对于晶体药物,多具有多晶型。研发过程中,为了保证药物晶型稳定,多选择优势晶型,即需要所选晶型满足安全,有效,稳定,满足生产的要求。优势晶型多为该药物最稳定的晶型,即能量较低的晶型,通常也表现出该晶型溶解度较低。当由于其晶格能较强使溶解度问题已经成为其发挥疗效的绝对的限速步骤时候,这个时候不妨可以选择亚稳定晶型,甚至非晶体结构(无定型)。当然,当使用这些特殊的晶型结构时候,需要严格控制晶型的稳定性,因为亚稳定性及无定型态皆易于转变成稳定性。犹如水往低处流,高能态势必转化成低能态。根据目前上市的药物品种来看,尽管无定型态高能且不稳定,为了解决药物难溶性问题,仍旧有许多药物逆风翻盘。
举例:无定型固体分散体技术可以通过打破晶体药物晶格能的限制,提高难溶性药物在溶出介质的溶出。
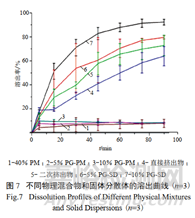
伊曲康唑作为三唑类高效广谱抗真菌药,由杨森制药于1992年在美国研制上市。其为白色结晶粉末,几乎不溶于水,属于BCS Ⅱ类药物。通过热熔挤出制备固体分散体,与物理混合物(折线1、2、3)相比,固体分散体(折线4、5、6、7)极大的提高了制剂的溶出。
针对药物亲水性差而造成药物的溶解性问题,不妨可以试试增加药物与溶剂之间的连接,比如使用脂质体,聚合物胶束等新型的药物递送系统。聚合物胶束一般为两亲性聚合物,由亲水段和疏水段构成。聚合物分散在介质中,当达到临界胶束浓度后,为了使整个体系能量达到最小化,疏水段朝内聚集在一起,亲水端朝外,与水性介质通过氢键等作用力结合,这样就形成了聚合物胶束的核-壳结构。对于难溶性药物可以装载在聚合物胶束的疏水段,避免了难溶性药物在溶剂中的析出。纳米级的药物递送系统在血液循环中透过肿瘤血管中的薄弱环节进入肿瘤组织。目前,研发机构已经报道了更加智能的环境响应性递送系统,如根据肿瘤微环境中pH的差异,温度的差异,糖代谢的不同等,设计的环境响应型聚合物胶束。
纳米载体的优势:
1. Increase the stability of any volatilepharmaceutical agent, easily and cheaply fabricated in large quantities by amultitude of methods.
2. They offer a significant improvement overtraditional oral and intravenous methods of administration in terms ofefficiency and effectiveness.
3. Deliver a higher concentration of pharmaceuticalagent to a desired location.
4. Choice of polymer and the ability to modify drugrelease from polymeric nanoparticles.
药物难溶性已经成为了药企新药研发过程中,尤为突出且亟待解决的问题。目前企业中,针对难溶性药物如何提高其溶解度问题上,多直接采用降低其粒度的手段,把化合物微粉化至微米级,降低了晶体结构的体量,当然这样可以提高难溶性化合物与溶剂之间的接触面积,进而提高药物的溶出速率。在保证微粉化操作不改变化合物晶型的前提下,化合物的溶解度是不变。化合物稳固的晶体结构是否制约了化合物的溶解,微粉化能提高药物溶出速率至多少,微粉化是否会带来制剂生产过程中的其他问题,如化合物聚团,难以混和均匀等。
伴随着技术的发展与研发企业的资金投入,尝试使用新的技术手段以及新的药物递送方式,或许可以给药物难溶性的解决带来曙光。当然,学习和掌握这样的技术,建立相应的技术平台,是艰难,不仅需要大量资金人力的投入,也需要多年的默默研究。研究不一定有立竿见影的成效,但是一旦掌握这种技术,其带来的技术壁垒将是竞争对手一时难以被攻克。长江后浪推前浪,中国医药江湖瞬息万变,创新驱动发展仍是在这个江湖中抢滩登岸的秘诀。
药物只有溶解才能被人体所吸收,也只有药物被吸收以后才能发挥作用。可见,良好的溶解度是药物在人体内发挥疗效的必须。学习和掌握溶解度溶解的原理,根据制约化合物溶解的限速步骤,采取相对相应的手段,对症下药,或许可以“起死回生”。拥抱新的技术与药物递送平台,即使短时间难见成效,未雨绸缪,失之毫厘,亦差之千里。
参考文献:
1. A Review on Pharmaceutical Nanotechnology forPoorly Water-Soluble (BCS -II/IV) Compounds.
2.药物固体分散体技术回顾与展望
3. 热熔挤出技术制备伊曲康唑固体分散体及体外溶出考察

来源: 药事纵横


