您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-22 14:41
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.汉光「尼替西农」国内获批上市。NMPA批准汉光药业尼替西农胶囊上市,用于治疗1型酪氨酸血症(HT-1)。尼替西农是MendeliKabs公司开发的一种4-羟苯丙酮酸双氧酶竞争性抑制剂,已在加拿大、欧盟等多个国家和地区上市;汉光药业拥有该药在中国区域的独家授权。值得一提的是,Swedish Orphan Biovitrum AB(SOBI)公司的原研产品尼替西农胶囊和尼替西农口服混悬液的中国上市申请目前已被纳入优先审评。
2.奥拉帕利国内获批新适应症。阿斯利康和默沙东联合开发的奥拉帕利(olaparib)新适应症上市申请获CDE批准,用于治疗转移性去势抵抗性前列腺癌。奥拉帕利是一款“first-in-class”PARP抑制剂,已于2018年8月在国内获批用于铂敏感复发性卵巢癌患者的维持治疗,是首个在中国获批上市的卵巢癌靶向新药。2019年11月,奥拉帕利再次获得CDE批准,用于携带BRCA突变的晚期卵巢癌患者的一线维持治疗。
3.百济神州PD-1单抗2项新适应症即将获批。百济神州PD-1抗体药物百泽安(替雷利珠单抗)2项新适应症上市申请已处于“在审批”阶段,预计即将获批上市,用于治疗经治的不可切除肝细胞癌患者;以及联合化疗用于治疗一线晚期非鳞状非小细胞肺癌(NSCLC)患者。目前,替雷利珠单抗在国内获批的3项适应症分别为:复发/难治性经典型霍奇金淋巴瘤;经治的局部晚期或转移性尿路上皮癌;联合化疗一线治疗晚期鳞状NSCLC。
4.荣昌ADC品种新适应症拟纳入突破性治疗品种。荣昌生物维迪西妥单抗(爱地希®,RC48)新适应症获CDE拟纳入突破性治疗品种,用于既往接受过曲妥珠单抗和紫杉类药物治疗的HER2阳性存在肝转移的晚期乳腺癌患者。该新药是我国首个原创性抗体偶联药物(ADC)新药,已获NMPA附条件批准上市,用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌患者的治疗。
5.瑞科生物完成近10亿元人民币C轮融资。瑞科生物完成由清池资本和淡马锡联合领投的约10亿元人民币C轮融资。该公司的产品管线包括HPV系列疫苗、重组带状疱疹病毒疫苗、结核病疫苗、重组新冠疫苗等等。HPV疫苗系列产品包括HPV16/18型二价疫苗、HPV6/11型二价疫苗,以及HPV6/11/16/18/31/33/45/52/58型九价疫苗、目前均处在临床开发阶段。本轮融资将主要用于公司产业化基地建设、重组新冠疫苗、HPV九价疫苗等产品临床试验等。
国际药讯
1.BMS治疗AML新药欧盟获批。欧盟批准百时美施贵宝低甲基化剂阿扎胞苷片(Onureg)上市,用于在诱导治疗后获得完全缓解(CR)或血小板计数未完全恢复的完全缓解(CRi)、并且不适合或选择不进行造血干细胞移植(ASCT)的急性髓性白血病(AML)成人患者的一线维持治疗。在一项QUAZAR AML-001研究中,Onureg一线维持治疗将总生存期显著延长近10个月(中位OS:24.7个月vs14.8个月,p=0.0009)、将无复发生存期显著延长一倍多(中位PFS:10.2个月vs4.8个月)。
2.赛诺菲Aubagio欧盟获批用于儿科患者。欧盟委员会(EC)批准赛诺菲Aubagio(特立氟胺)扩大适用人群,用于一线治疗年龄10-17岁的复发-缓解型多发性硬化(MS)儿科患者。这也是是欧盟批准用于一线治疗MS儿童和青少年的首个口服MS疗法。在中国,Aubagio(中文商品名:奥巴捷)于2018年7月获批上市,是国内批准治疗MS的首个口服疾病修正治疗(DMT)药物。
3.诺华基因疗法品种Ⅲ期临床积极。诺华(Novartis)在EAN2021会议上公布其基因疗法Zolgensma(onasemnogene abeparvovec)治疗脊髓性肌萎缩症(SMA)的两项Ⅲ期研究最新数据。SPR1NT研究双拷贝队列的新数据显示,接受该药治疗的症状前SMA儿童在没有任何呼吸或营养支持的情况下达到了年龄相适应的里程碑发育,并且没有出现严重的治疗相关不良事件;STR1VE-EU试验数据表明,Zolgensma能迅速改善患者运动功能,有82%的患者达到1型SMA疾病自然史中未观察到的运动里程碑。安全性与先前报告的数据一致。
4.巴替利单抗获FDA优先审评资格。FDA受理Agenus公司PD-1单抗balstilimab(巴替利单抗)用于治疗复发性或转移性宫颈癌的生物制品许可申请(BLA),FDA同时授予其优先审查资格,PDUFA日期为今年年底。一项关键Ⅱ期临床最新数据显示,该新药在PD-L1阳性肿瘤的缓解率为20%,在所有肿瘤(PD-L1阳性和阴性)的缓解率为15%,中位反应持续时间为15.4个月。贝达药业拥有balstilimab在大中华区的权益。
5.CD19靶向ADC新药Zynlonta临床积极。瑞士ADC Therapeutics SA公司在ICML2021年会上公布其CD19靶向性抗体偶联药物(ADC)Zynlonta(loncastuximab tesirine-lpyl)治疗恶性淋巴瘤的2项临床(LOTIS-2和LOTIS-3)新数据。其中,在LOTIS-2试验中,Zynlonta在先前接受过多种疗法的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)患者中的中位缓解持续时间(DOR)达到13.4个月。在LOTIS-3试验中,Zynlonta联合伊布替尼(BTK抑制剂)在复发或难治性DLBCL和套细胞淋巴瘤(MCL)患者中的的ORR为62.2%、CRR为35.1%。
6.热休克反应诱导剂NDA被拒。FDA针对Orphazyme A/S公司小分子热休克应激反应诱导剂Miplyffa(arimoclomol)用于治疗C型尼曼-匹克病(NPC)的新药申请(NDA)发布一封完整回应函(CRL)。FDA需要更多的定性和定量证据来进一步证实5域(5-domain)NPC临床严重程度量表(NPCCSS)的有效性。此外,FDA在CRL中指出,除了单个Ⅱ/Ⅲ期临床试验外,还需要额外的数据来支持对NDA的益处-风险评估。
医药热点
1.甘肃拟招定向医学生500名。据甘肃省教育考试院透露,2021年甘肃省计划招录临床医学专业、中医学专业农村订单定向三年制专科医学生500名,其中,甘肃中医药大学100名(中医学),甘肃医学院125名(临床医学),河西学院125名(临床医学),甘肃卫生职业学校150名(临床医学)。学生在校学习期间享受省级财政补助,按每人每学年1万元给予补助,3年共补助3万元。
2.加拿大不建议接种阿斯利康新冠疫苗。加拿大全国免疫接种咨询委员会(NACI)日前发布了新冠疫苗接种的最新指导意见。该指导意见建议各省在绝大多数情况下都不要再接种阿斯利康疫苗,即便是那些第一剂接种了阿斯利康疫苗的人,也要改用其他疫苗,如同属mRNA疫苗的辉瑞或者莫德纳疫苗。
3.东莞本轮首例新冠确诊感染来源查明。东莞市疾控中心副主任罗东在新闻发布会上宣布,东莞18日确诊的首例新冠肺炎病例,其阳性标本经广东省疾控中心样本二代基因测序,结果显示与本次广州疫情的基因组序列均属于Delta株,但与广州疫情基因组序列存在较大的差异,未发现广州本次疫情中后期所共有的变异位点,提示分别来自不同的传染来源。
审评动向
1. CDE新药受理情况(06月21日)
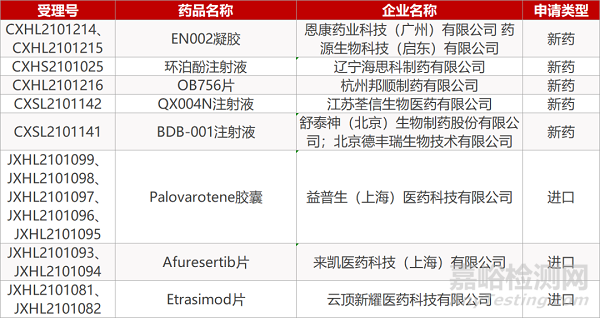
2. FDA新药获批情况(北美06月17日)
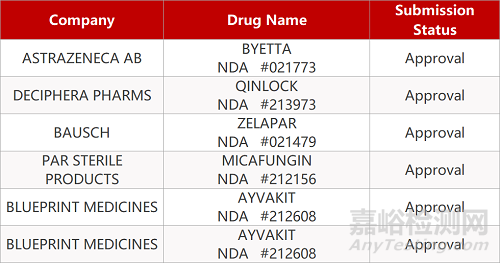

来源:药研发


