您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-23 14:15
1 实时放行检测
实时放行检测(Real Time Release Testing,RTRT)是指通过测量工艺参数和物料属性来评价和保证中间产品与成品质量的能力。RTRT与PAT密不可分。PAT提供了一种控制和追溯的手段,并不一定导致RTRT的发生,但是反之,实现RTRT所需的工艺参数和质量属性监测信息,很难通过PAT以外的其他方式获取,因此PAT的最终目标之一就是实现RTRT。
RTRT是“升级版”的参数放行。参数放行主要针对最终灭菌制剂,通过对已验证的灭菌工艺参数的监控来免除放行检测的无菌项目,以加快放行速度;而RTRT适用于所有药品,监控的对象也扩大到工艺参数和质量属性。如果RTRT能够覆盖物料所有的CQA,那么终产品就可以免检直接放行;反之,如果RTRT不能覆盖到物料所有的CQA,就需要补充执行针对这部分CQA的终产品检验。RTRT是一个过程和手段,并不代表放行这一个动作。RTRT和终产品检验都可以支持批放行决策,但还要考虑批生产记录、GMP 情况以及质量体系情况,通过综合评估来确定产品能否放行。
原则上,一旦建立了产品的RTRT,就必须要把这一控制策略应用于批放行决策,不能再依赖终产品检验。即使RTRT的结果超标,也不能通过对终产品补充检验来支持放行(即使终产品检验合格)。对于RTRT的任何超标均应进行调查,并跟踪其趋势,根据调查结果做出是否放行的决策。另一方面,实施RTRT也不代表产品完全不需要进行常规检验。因为RTRT仅能证明产品放行时质量符合要求,却无法证明产品在货架期内质量始终符合要求。仍然需要建议一套常规检验的方法和货架期标准,用于产品的稳定性研究和货架期测试。
2 停留时间分布
生产线运转时,物料依次连续流经各个设备,物料中某个质点经过一定容积的一台设备或容器,从进入到离开所历经的时间叫做停留时间(Residence Time)。由于难以追踪大量物料中某一个质点的运动,在宏观层面,将处于受控状态的一台设备或容器所包含的物料质量(体积)除以物料的质量流速(体积流速),就得到了物料在这台设备或容器的平均停留时间(Mean Residence Time,MRT)。MRT可以理解为一个设备或单元操作处理和转化物料所需要的平均时间。
如果物料中所有质点都以相同的时间流经一个设备或单元操作,那么这个系统被称为平推流系统(Plug Flow System)。比如前文介绍的PFR,由于物料在径向流速处处相等,因此所有物料质点都花费了同样的时间穿过反应器。对于平推流系统,所有质点的停留时间与MRT相等。理想的平推流系统物料不发生返混,任何输入物料的质量波动和工艺波动也会直接反映在输出物料中。反之,如果物料中所有质点的停留时间都不尽相同,也即意味着系统中部分物料停留时间长,部分物料停留时间短,这种系统被称为返混系统(Back Mixing System)。比如前文介绍的CSTR,在一个反应釜内,输入的物料直接与容器内所有物料混合,同一时间输入的物料不可能在同一时间输出。理论上输入返混系统的物料有可能立刻就被输出,也可能一直停留在系统内。因此对于返混系统,输入物料的质量波动不会直接引起输出物料相对应幅度的波动,而是会缓慢地作用于系统所容纳的物料中。输出物料质量波动的变化率取决于设备/容器的特征、停留体积和返混程度。
用于描述返混程度的函数就是停留时间分布(Residence Time Distribution,RTD)函数。RTD描绘了物料在设备/单元操作内停留不同时间的可能性,函数图像峰形越宽,表示停留时间可能的变化范围越大,也意味着返混(轴向混合)越明显。图1展示了CSTR系统内含有不同反应釜数量时的模拟RTD曲线,反应釜数量N取1~90;横坐标θ表示无量纲的停留时间参数(即停留时间与MRT的比值);纵坐标Eθ代表无量纲的分布特征值,Eθ越大,表示该θ值的出现概率越大。从图中可以看出,N取值越大,RTD峰形越窄,θ峰值越接近1,返混程度越小;当N→∞时,图像将会在θ=1处出现一条垂直线段,此时系统即成为一个理想的平推流系统。因此在CSTR系统中,在保持系统其他参数不变的情况下,所包含的反应釜数量越多,系统返混程度就越低,越趋近于平推流系统。
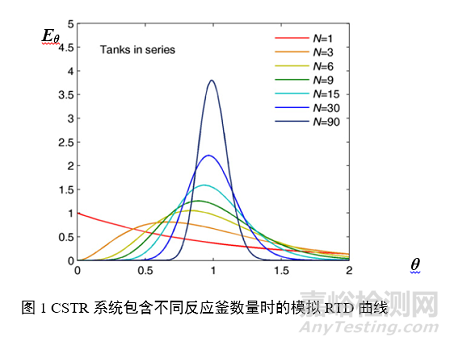
研究RTD曲线可以帮助理解工艺波动对物料的影响,尤其是当工艺出现偏差时,RTD能够帮助追溯到那些受影响的产品,保留未受影响的产品,从而减少浪费。RTD可以通过物料追踪实验或工艺建模来获得。Simonaho等人报道了一种测量连续式混合机RTD曲线的方法,研究使用了一个含5%乙酰氨基酚作为API的片剂连续生产线,API浓度通过混合机出料口的NIR探头测量。在生产线正常运转,NIR基线稳定时,手动一次性向混合机进料口投入10 g对乙酰氨基酚API,以该时间为零点,实时监测出料口的API浓度,即可获得API浓度-时间曲线,再通过归一化方法获得该设备在一定参数条件下的RTD曲线。Mangal等人报道了另一种利用示踪剂研究RTD的方法,在正常运转的设备中加入20 g由20%氧化铁红示踪剂与80%辅料混合成的料带,由于氧化铁红的浓度直接表现为输出物料的颜色深浅,因此该研究通过ExtruVis 3图像采集和分析系统就能够直接获得当前工艺参数下的RTD曲线。
3 设备开停机的物料停留
连续制造与传统批生产的另一个关键区别在于连续制造有明显的开停机过程。传统生产模式中所有物料一次性投入到设备中、开机运转、经过一定时间后停机、一次性移出所有产品;连续制造工艺的生产线开机时,此时所有物料都应位于喂料器的料斗内,生产线上并没有待处理的物料。随着时间推移,物料逐渐依次加载至生产线上的各个设备,设备逐渐从初始化状态转变为受控状态;生产结束前喂料器料斗清空,物料逐渐依次离开生产线上的各个设备,待生产线上所有物料均输出为产品后,生产线停机。因此连续制造设备在开停机过程中都需要经历一个物料加载和卸载的状态,这一状态对物料转化和产品质量的影响是需要着重研究的。
Simonaho等人记录了一条干法制粒片剂连续制造生产线的开机操作:生产线的批量为20 kg/h,0 min时开启喂料机和混合机,15 min时开启干法制粒机,20 min时开启压片机,得到第一片产品,此时整条生产线上加载的物料总质量为6.6 kg。关机时也是类似的情况,因此对于这条20 kg/h的生产线,一次开关机操作就有10 kg以上的产品需要报废处理,产生了巨大的浪费。因此Matsunami等人也指出对于连续制造技术,研究如何减少开关机期间的物料浪费对于提高收率、降低成本具有重要意义。尤其是对于临床试验用药品的生产来说,每批所需的总批量并不多,开关机步骤造成了很大比例的浪费。Byrn等人提到了一种可行的方法,即在开机前先混合机加料至满载,以批生产的方式(既不输出物料也不再输入物料)先单独运行几分钟,待混合均匀后再转为连续模式,这样就可以减少可观的物料浪费。但需要注意的是,这种模拟批生产的运行方式无法符合连续制造中的“受控状态”,因此需要加强对该部分物料的检测,并充分验证这种工艺模式的稳健性。
4 结语
连续制造和智能制造是“工业4.0”时代绕不过的话题。尽管制药行业受限于法规和合规原因,对于新技术新概念的接纳要慢于其他行业,但相信未来会有越来越多的企业尝试和接纳连续制造这一高效率低成本的技术作为发展的方向。目前国际法规环境也在逐渐开放和接纳新技术,FDA和PMDA已经发布了连续制造的有关指南,ICH《Q13:原料药和制剂的连续制造》指南也在起草中。因此本文也呼吁中国监管机构尽快研究制订相关指南,引导有能力的国内企业试点连续制造等新技术,分享科技进步带来的红利。
(全文完)
参考文献
[1] Simonaho S P,Ketolainen J, Ervasti T, et al. Continuous manufacturing of tablets withPROMIS-line—Introduction and case studies from continuous feeding, blending andtableting[J]. European Journal of Pharmaceutical Sciences, 2016, 90: 38-46.
[2] Matsunami K,Nagato T, Hasegawa K, et al. A large-scale experimental comparison of batch andcontinuous technologies in pharmaceutical tablet manufacturing usingethenzamide[J]. International journal of pharmaceutics, 2019, 559: 210-219.
[3] ICH. Q8(R2):Pharmaceutical Development[EB/OL]. (2009-08-01)[2020-04-02]. https://www.ich.org/.
[4] EuropeanCommission. EU Guidelines for Good Manufacturing Practice for MedicinalProducts for Human and Veterinary Use: Annex 17: Real Time Release Testing andParametric Release[EB/OL]. (2018-06-26)[2020-04-02]. https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-4/pdfs-en/2018_annex17_en.pdf
[5] Gao Y, MuzzioF J, Ierapetritou M G. A review of the Residence Time Distribution (RTD) applicationsin solid unit operations[J]. Powder technology, 2012, 228: 416-423.
[6] Mangal H,Kleinebudde P. Experimental determination of residence time distribution incontinuous dry granulation[J]. International journal of pharmaceutics, 2017,524(1-2): 91-100.
[7] Byrn S,Futran M, Thomas H, et al. Achieving continuous manufacturing for final dosageformation: challenges and how to meet them. May 20–21, 2014 continuousmanufacturing symposium[J]. Journal of pharmaceutical sciences, 2015, 104(3):792-802.
[8] ICH. ConceptPaper for Q13: Continuous Manufacturing of Drug Substances and Drug Products [EB/OL].(2018-06-22)[2020-04-02]. https://www.ich.org/.

来源:药事纵横


