您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-27 23:34
脉搏波速度和踝臂指数检测器械是以示波法通过袖带传感器取得的压力和脉搏信号来自动完成间接测量的装置。
一、脉搏波速度和踝臂指数检测器械的结构与工作原理
1.脉搏波速度和踝臂指数检测器械的结构
产品一般由主机、袖带和附件组成。一般产品还带有信号输入输出部分,主要用于测量数据的导出和管理。产品结构框图举例如图1。
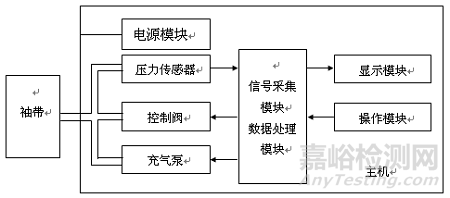
图1. 产品结构框图举例
2.脉搏波速度和踝臂指数检测器械的工作原理
测量脚踝和上臂的血压比指数(简称“ABI”)以及脉(搏)波传播速度(简称“PWV”)的原理如下:
1)脚踝和上臂的血压比指数测量
采用示波法测量血压,工作原理按测量方式为降压测量法。降压过程中,动脉内压力振幅大小变化趋势如图2所示:
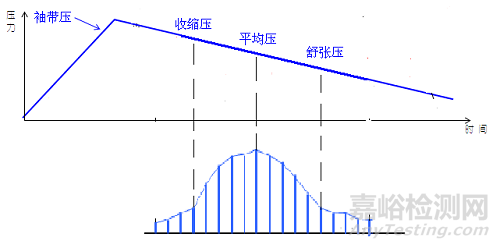
图2. 动脉内压力振幅大小变化趋势
压力传感器采集大小变化的袖带内压力,将其转化为数字信号送入CPU,通过软件组件辨别动脉血流受阻过程中相应压力点,根据经验累积的软件算法分别得出脚踝和上臂的舒张压和收缩压。并按照以下公式可以计算出ABI值:
ABI = 脚踝收缩压/上臂收缩压
2)脉搏波传播速度测量
检测某一个脉搏波到达脚踝和到达上臂、或是到达颈动脉—股动脉之间的时间差,可以在ABI的血压测量过程中进行,也可以单独进行。最终通过下面的公式计算出PWV:
baPWV = 脚踝至上臂的距离/时间差
cfPWV = 颈动脉至股动脉的距离/时间差。
二、脉搏波速度和踝臂指数检测器械的研发实验要求
1. 性能研究
应当包括产品性能研究以及产品技术要求的研究和编制说明,包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
应描述所采用的国家标准、行业标准中不适用条款的理由。
2. 软件研究
软件研究应参见《医疗器械软件注册技术审查指导原则》(国家食品药品监督管理总局通告2015年第50号)和《医疗器械网络安全注册技术审查指导原则》(国家食品药品监督管理总局通告2017年第13号)。应给出一份单独的医疗器械软件描述文档和一份网络安全文档,软件描述文档内容包括基本信息、实现过程和核心算法,详尽程度取决于软件的安全性级别和复杂程度。应在产品技术要求中明确软件发布版本和软件完整版本号的命名规则。
3.生物相容性研究
生物相容性评价根据GB/T 16886.1标准进行,应描述产品所用材料及其与人体接触的性质,如:产品袖带所采用的材料,与人体接触为直接接触。生物相容性评价研究应给出实施或豁免生物学试验的理由和论证,并对现有数据或试验结果进行评价。
4.消毒工艺研究
应明确所推荐的清洁、消毒工艺(方法和参数)及其确定依据,并给出验证报告。
5.使用次数和包装研究
1)使用次数的确定:应当给出产品寿命信息及验证资料。
2)包装及包装完整性:应当给出产品包装的信息,以及在宣称的有效期内以及运输条件下,保持包装完整性的依据。
6.技术指标
应当按照《医疗器械产品技术要求编写指导原则》(国家食品药品监督管理总局通告2014年第9号)编制产品技术要求。
1)产品应符合YY 0670—2008中规定的要求。
2)产品应符合GB/T 14710—2009中气候环境和机械环境II组的要求。
3)产品应符合GB 9706.1—2007中规定的要求。
4)产品应符合YY 0505—2012中规定的要求。
三、相关标准
表1. 产品适用的相关标准
|
标准编号 |
标准名称 |
|
GB 9706.1—2007 |
医用电气设备第1部分:安全通用要求 |
|
GB 9706.15—2008 (如适用) |
医用电气设备第1—1部分:安全通用要求并列标准:医用电气系统安全要求 |
|
GB/T 14710—2009 |
医用电气环境要求及试验方法 |
|
GB/T 16886.1—2011 |
医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
|
GB/T 16886.5—2003 |
医疗器械生物学评价第5部分:体外细胞毒性试验 |
|
GB/T 16886.10—2005 |
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验 |
|
GB/T 16886.12—2005 |
医疗器械生物学评价第12部分:样品制备与参照样品 |
|
YY 0505—2012 |
医用电气设备第1—2部分:安全通用要求并列标准:电磁兼容—要求和试验 |
|
YY 0670—2008 |
无创自动测量血压计 |
|
YY/T 0316—2016 |
医疗器械风险管理对医疗器械的应用 |
|
YY/T 0466.1—2016 |
医疗器械用于医疗器械标签、标记和提供信息的符号 |
|
YY/T 0664—2008 |
医疗器械软件 软件生存周期过程 |
|
YY/T 0708—2008 |
医用电气设备第1—4部分:安全通用要求:可编程医用电气系统 |
四、主要风险
产品的危害类型及形成因素举例见表2。
表2. 产品的危害类型及形成因素
|
危害 |
可预见的事件序列 |
危害处境 |
损害 |
|
电磁 能量 |
在强电磁辐射源附近使用产品测量,干扰系统运行,测量错误、测量结果误差过大。 |
依据过高读数服用治疗药物,导致药物剂量过量。 |
误用药物、严重时可能危及生命。 |
|
依据过低读数不进行治疗。 |
病情未即时控制,严重时恶化。 |
||
|
电源线中有雷击能量 |
设备故障、寿命缩短。 |
设备无法及时使用。 |
|
|
静电放电 |
干扰程序运行。 |
导致测量结果误差过大、或数据擦除。 |
|
|
漏电流 |
产品配用漏电流超标的电源适配器 |
使用者、患者接触时可触及的带电部分。 |
灼伤、严重时死亡。 |
|
热能 |
使用负载能力较差的电源适配器 |
适配器中的部件过热。 |
烫伤、严重时起火。 |
|
机械能 |
产品最高袖带压未作规定或限值过高、测量周期过长、放气阀门故障导致放气失败。 |
过高、过长时间的压力作用于人体。 |
淤血、感觉不适、外周血管阻滞。 |
|
产品意外坠落。 |
机械部件松动,液晶板接触不良。 |
无法测量或测量误差过大,数据无法读取,严重时延误治疗。 |
|
|
不正确的测量 |
压力传感器长时间未经校准,压力传感器测量偏差、压力传感器超出使用寿命,传感器测量偏差。 |
依据过高读数进行治疗或者服用药物,导致药物剂量过量。 |
误用药物,严重时可能危及生命。 |
|
依据过低读数不进行治疗。 |
动脉硬化未经控制,严重时引起病情恶化。 |
||
|
生物学 |
使用生物相容性不良的材质制作袖带 |
人体接触。 |
皮肤过敏、刺激。 |
|
化学 |
长时间不使用的电池未经取出,造成电池漏液。 |
电路腐蚀、设备故障,产品无法工作。 |
延误治疗。 |
|
操作 错误 |
使用不适当尺寸的袖带,袖带未扣紧。 |
未能对被测部位的血管完全压迫。 |
测量失败;测量值误差过大,见“不正确的测量”。 |
|
测量部位与心脏高度不一致,被测者姿势不良 |
测量部位与心脏压力存在压差。 |
||
|
测量时被测者活动,说话,情绪的变化。 |
压力信号中混杂噪声。 |
||
|
在产品规定的温度范围外测量。 |
超出传感器温度线性范围。 |
||
|
不完整的说明书 |
未对错误操作进行说明。 |
见“操作错误”。 |
测量失败;测量值误差过大,见“不正确的测量”。 |
|
不正确的消毒方法。 |
使用有腐蚀性的清洁剂、消毒剂。产品部件腐蚀,产品无法工作。 |
延误治疗。 |
|
|
不正确的产品贮存条件。 |
器件老化,部件寿命降低。 |
产品寿命降低,导致测量值误差过大,见“不正确的测量”。 |
|
|
未规定检测方法。 |
传感器存在偏差,未对设备进行校准。 |
见“不正确的测量”。 |

来源:嘉峪检测网


