您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-30 15:40
摘要: 自2020-07-01 实施突破性治疗药物工作程序以来,肿瘤适应症占全部申请的70%,抗肿瘤新药突破性治疗药物的认定标准备受关注。本文对肿瘤适应症小组在突破性治疗药物认定工作中学习、思考和讨论的成果进行综述,以期提出科学的认定标准供行业参考和指正。
随着基础医学的进步和对疾病认识的不断深入,新药研发越来越具有目的性和方向性。如今,肿瘤治疗从最初的细胞毒性产品时代进入靶向治疗时代,在多学科共同发展的推动下,涌现出不少机制和疗效都具有突破性意义的创新产品。这些给临床实践带来颠覆性改变的产品,无一不在早期临床试验阶段就表现突出。为了能通过早期临床研究数据发掘出具有突出临床优势的创新药物,优化临床研发的资源配置,缩短其临床研发周期,使罹患严重危及生命或严重影响生存质量疾病的患者早日获得更好的治疗,2020-07-01 起实施的现行《药品注册管理办法》[1]将突破性治疗药物程序列为药品加快上市注册程序。这一工作程序受到了药品研发行业的普遍关注,突破性治疗药物的认定标准也成为业界和学术界关心的焦点之一,肿瘤适应症小组将认定过程中学习、思考和讨论的成果综述于本文,为行业提供帮助和指导并寻求指正。
1 中国突破性治疗药物工作程序简述
《药品注册管理办法》对突破性治疗药物程序的适用范围有非常明确的要求,即: 药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以申请适用突破性治疗药物程序。这一工作程序的目的,在于鼓励针对具有迫切临床需求的疾病,研制具有明显优势的创新产品,对于在作用机制、治疗方向/目标、以及对疾病预后或生活质量的改善方面较现有治疗手段有重大突破的药物,从临床研发早期即给予资源上的倾斜。
为了使突破性治疗药物认定工作的开展规范有序,国家局配套发布了《突破性治疗药物审评工作程序( 试行) 》[2]( 简称《工作程序》) 。《工作程序》提出了明确的突破性治疗药物适用范围和适用条件,提供了“严重危及生命”“严重影响生存质量”“现有治疗手段”及“具有临床意义的终点”等关键概念的定义,罗列了可能被考虑为突破性治疗药物的多种情形。
申请人在临床试验期间按照具体的适应症在申请人之窗的“突破性治疗药物程序申请系统”中提出申请;药审中心对产品已有的数据进行评价,并与历史数据进行比较,在收到申请后45 日内反馈审核结果,期间可根据需要召开专家咨询会; 药审中心按要求公示拟纳入突破性治疗的药物,5 日内无异议方可正式纳入突破性治疗药物。获得突破性治疗药物资质的产品,在后续临床研发过程中可以得到更多的沟通交流的机会,并且可以有机会提出Ⅰ类会议申请,在更短的时间内得到反馈。沟通交流的内容可以包括且不限于研发和注册计划、具体的临床研究方案设计、研发过程中遇到的技术和政策问题。临床研究或新药注册申请审评过程中,纳入突破性治疗药物程序的产品可能因为安全有效性数据不再支持其具有明显的临床获益,程序会被终止[药研公众号整理排版]。
需要强调的是,一种药物获得突破性治疗资质并不意味着可以依据不完整的临床研究资料批准该产品上市。监管机构或者有经验的审评人员的早期加入,是为了帮助申请人及时发现研究中存在的问题,提出巧妙灵活又能满足监管要求的研究策略,以尽可能少的样本量和研发时间获得足以证实临床价值的安全有效性数据,减少因关键性研究方案设计缺陷导致的失败。突破性治疗药物的身份可以让产品在临床研究期间得到更多的关注,吸引到更多的社会资源和支持。集中力量服务于具有最迫切临床需求的患者人群,将有限的审评和临床资源向最具潜力的优势产品倾斜,是以患者利益为中心和提高社会公平性的具体体现。
自2020-07-01 开始实施突破性治疗药物程序以来,截至2021-03- 04,药审中心已经收到了188份申请,其中与肿瘤适应症相关的申请共140 份。共33 个品种( 同品种相同适应症但不同受理号下提交的申请被合并) 被正式纳入突破性治疗,其中肿瘤相关适应症品种24 个。
2 美国突破性治疗程序的历史和实施情况
中国的突破性治疗药物程序在很大程度上借鉴了美国食品药品监督管理局( U. S. Food and Drug Administration,FDA) 的突破性疗法认定( breakthrough therapy designation,BTD) 理念。FDA 针对严重疾病实施4 种加快程序( expedited programs) ,即快速通道( fast track designation) 、BTD、加速审批( accelerated approval) 和优先审评( priority review designation) 。加快程序强调未满足的临床需求,尤其针对严重危及生命或严重影响生存质量的疾病,目的都是缩短那些具有突出临床价值的新药的研发周期,在提高研发效率的同时并不降低标准。根据适应症的特征和产品在临床试验中已经表现出来的价值,FDA 可以适当地接受不确定性,在可做出获益大于风险的可靠预测或结论时,尽快批准优势产品上市。FDA 于2012 年7 月推出的突破性治疗程序是上述加快程序中最晚实施的,推出这一程序的原因,恰恰是其他3 项程序并没有理想地实现缩短有突出价值产品研发周期或提高研发成功率的目标。快速通道允许创新产品基于临床前数据即提出申请,而BTD 程序更强调人体临床研究数据。相比于加速审批和优先审评,BTD 程序更强调监管机构在临床研发阶段的充分参与,BTD 程序的申请节点则给监管机构提供了在产生关键性注册数据前与申请人密切互动并及时提出建议的可能。
FDA 推出BTD 程序,一定程度上受到了vemurafenib 和BRAFV600E伴随诊断成功上市的启发。FDA 已经实施BTD 程序近9 年。截至2021-02-11,FDA 一共收到1111 个BTD 申请,其中436 个申请( 200 个申请为肿瘤产品) 获得认可, 201 个BTD 药物( 125 个肿瘤产品) 已经获批上市。由于刚刚获得BTD 认可的产品也在计算之列,上述数据意味着BTD产品临床研发的成功率超过46% ( 肿瘤产品为62. 5%) ,远高于一般产品的成功率[3]。一项研究[4]对FDA 在2012-01-01 至2017-12-31 期间批准的58 个抗肿瘤新药进行了分析。其中25 个( 43%)在批准前曾经获得过BTD 的产品,从递交新药临床试验申请( innovative new drug, IND) 到首次获批上市的时间( 简称“首次上市耗时”) 中位值为5. 2 年,而非BTD 产品的中位时间为7. 1 年( 差值1. 9 年,P =0. 01) 。26 个加速批准的新药中,未曾获得BTD 的9个产品中位首次上市耗时8. 3 年,但17 个BTD 产品的中位耗时仅4. 8 年( P < 0. 01) 。非常重要的是,即使BTD 产品的研发用时大大缩短,却并没有牺牲缓解率( response rate,RR) 、无进展生存时间( progression free survival,PFS) 、安全性方面的表现,BTD 产品延长PFS 的结果在数值上还优于非BTD 产品( 表1) 。由于BTD 产品中更高比例( 64%,非BTD 产品为36%) 采用RR 作为关键性注册研究的主要疗效终点( 表1) ,因此该研究的结果还不能反映所有BTD 产品在PFS 或者生存时间( overall survival,OS) 上的表现。以上结果表明,BTD 程序在提高研发成功率或缩短研发周期方面成绩斐然。
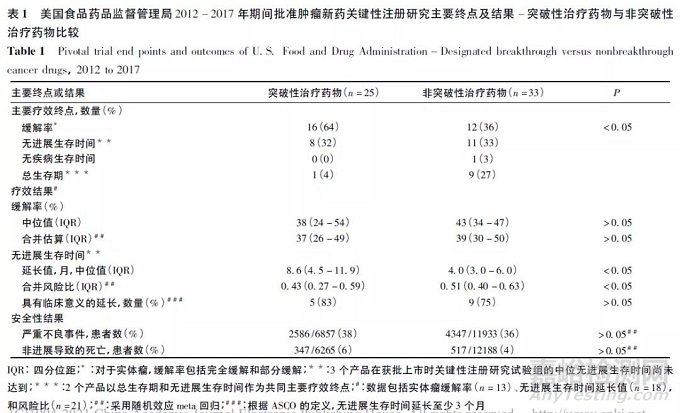
BTD 程序给新药研发带来的各种优惠使得评定过程中的标准备受关注。FDA 的指南中强调用于支持BTD 申请的数据应该来自于相对充分的样本量,对产品相比于现有治疗具有明显临床优势的预测应该具有说服力,但指南也承认要求数据完全成熟是不切实际的。针对如何判断“明显临床优势”,指南指出这取决于2 个方面: 以具有临床意义的终点为衡量指标( 包括效果的持续时间) ,药物能带来的改善程度; 所观察到的效果对于治疗严重疾病的价值。FDA 鼓励采用早期对照研究,也接受采用记录完整的数据作为历史对照的单臂研究结果,但对单臂研究的结果可能会提出相对较高的期望值。指南中举例说明对于抗肿瘤产品,若单臂研究结果显示治疗后RR 相比于历史数据有显著提升,同时结合对缓解持续时间( duration of response,DOR) 的评价,可以作为BTD 评定的依据。但在评判原则之外,FDA 指南并未就具体多大样本量的数据可被判断为可靠,多大程度的改善可代表“明显临床优势”展开细节讨论,因为定义出一个适用于所有适应症的可代表“明显临床优势”的标准是不切实际的[5]。针对2015 年3 月前同时获得加速批准的9 个抗肿瘤BTD 药物的10 项临床研究数据进行回顾性分析[6],随机对照研究( 4 项) 和单臂研究( 6 项) 的结果都可以用于BTD 申请: 单臂研究的样本量范围为50 ~ 405 例,随机对照研究样本量范围为165 ~ 447 例。最常用的研究终点为RR + DOR 或PFS,相比于历史对照或者平行对照,BTD 产品基本满足以下条件之一: 缓解率增加至少1 倍并获得持久的DOR; PFS 延长至少1 倍; PFS 的风险比< 0. 5。由于该回顾性分析所纳入的临床研究数据已经足以支持产品获得加速批准,相比于一般的BTD 申请数据更为成熟,样本量的要求可能不具有代表性,但其分析结果还是为业界提供了具有价值的BTD 评价标准的参考信息。
FDA 工作人员针对截至2016-06-30 的BTD 申请的失败原因进行了分析[5],可以从中获得与BTD申请评价过程中决策要素相关的信息。4 年间,药品评价与研究中心( Center for Drug Evaluation and Research,CDER) 共收到364 份BTD 申请( 肿瘤产品122 份) ,133 份( 37%) 获得认定( 肿瘤产品64 份) ,182 份( 50%) 被拒绝( 肿瘤产品58 份) , 49 份( 13%)申请人主动撤回。理论上,Ⅰ至Ⅲ期研究的结果都可以用于支持BTD 申报,70% 的申请只包含Ⅰ期或Ⅱ期研究的数据,包含Ⅲ期数据的申请成功率更高,但是相应的研发时间也更长。获得认可的申请中58 份未包含随机对照研究的数据,其中32 份针对罕见病。样本量的范围变化较宽,部分申请的样本量不足50 例,但也有部分申请提供了1 000 例以上样本量的数据,样本量的大小与申请成功与否没有绝对的相关性。文章指出,所有最终获得同意的BTD 申请,其临床研究都是经过良好设计的,因此FDA 的审评员可以很直接地判断出数据中反映出的治疗效果来自于产品本身。182 份申请被拒绝的理由见表2,缺乏“明显临床优势”是最主要的原因( 60% ) ,研究设计缺陷、样本问题、主要疗效终点选择问题和数据不成熟/不完整都是重要的原因。

3 中国抗肿瘤新药突破性药物认定过程中的考量维度和一般标准
中国的突破性药物程序实施时间尚不足1 年,相比于FDA 的BTD 程序还有很多需要完善和成长之处。基于已有的审评经验,在抗肿瘤药突破性治疗审评的评价过程中,适应症小组形成相对比较统一的决策步骤和评价原则。在不同的适应症领域,同时结合产品本身的创新程度和作用机制,具体的标准可能会在合理范围内产生浮动。
评价该申请是否符合突破性治疗药物的适用范围需要满足以下全部4 条: ①创新药或改良型新药; ②临床试验期间,且在中国已经获得所申请适应症的临床试验通知书; ③在境内进入关键性/验证性/Ⅲ期注册临床研究前提出申请。若关键性/验证性/Ⅲ期注册临床研究初步数据显示产品具有突出的临床获益( 例如PFS /OS 风险比< 0. 4) ,可以考虑追加认定; ④应具备中国人群数据,可独立支持申请或足以与境外数据进行一致性趋势评价。
对申请中所涉及的适应症是否符合严重疾病的定义进行评价由于绝大多数肿瘤都属于这一类疾病,因此这一步通常可以简化。
重点对产品的有效性优势进行评价若数据来自随机对照研究,应该与现有标准治疗进行比较。若为单臂设计的研究,申请人应该同时提供质量良好的历史数据作为对照。对于非对照研究来源的数据,与拟定适应症相匹配的暴露样本量至少需要20 ~ 30例,这个要求会根据当前数据反映的改善程度、适应症人群的特征、现有治疗手段的可获得性有所调整。对于抗肿瘤药物来说,缓解率结合DOR、PFS、无事件生存时间、无疾病生存时间、总生存期都是可能用于支持申请的疗效终点,评价过程中会结合适应症特征、治疗目标和现有治疗手段对替代终点的临床意义和适用性进行评估。申请人若以缓解率作为判断有效性优势的终点时,应该至少提供3 个月的DOR 率作为缓解质量的评价依据。当前数据应至少证明产品可满足以下一种情形: 显著提高客观缓解率/完全缓解率并获得持久的DOR; PFS /无事件生存时间/无疾病生存时间获得突出且具有临床意义的延长; 对于生存期较短的瘤种,大幅度地改善患者的总生存期。
对产品的安全性进行初步评价评价产品是否在具有有效性优势的同时还有安全性上的改善。若产品有重大的安全性风险且影响整体的风险获益比,申请可能会因为安全性问题被拒绝。
4 申请不成功的原因分析
截至2021-03-04 收到的188 份申请中, 160 份已经审核结束或者由申请人主动撤回,其中98 份( 61. 3%) 经审核未通过认定,25 份( 15. 6%) 由申请人主动撤回。相比之下,FDA 在2012 - 2013 年共收到106 份申请,63 份( 59. 4%) 被拒绝,申请人主动撤回10 份( 9. 4%) 。通过与FDA 启动BTD 项目初期的数据相比较,中国的不通过率与FDA 是相近的。在中国递交的突破性药物申请中抗肿瘤产品相关申请共140 份,75 份审核后未通过,17 份申请被主动撤回。对未能成功获得认定的抗肿瘤产品相关申请进行分析,可以将原因分为法规相关和数据相关两类[药研公众号整理排版]。
法规相关原因主要包括: 申请的适应症在境外已经获批( 非新药/改良性新药) ; 已完成上市申请前沟通交流并已获准递交申请; 同一个申请中包含多个适应症或适应症填写不准确。上述情形主要集中在工作程序实施初期,随着申请流程的不断成熟,因法规原因被拒绝的申请逐渐减少。数据相关原因主要包括: ①样本量过少/数据不稳健。不少申请在提交时仅能提供不足10 例或十余例拟申报适应症人群的研究数据。②当前数据不能体现“明显临床优势”。这种情形主要是指对有效性的改善程度未达到标准。此外,以缓解率作为申请的主要疗效指标时,还应该同时提供随访时间/暴露时间、DOR 等相关信息,对缓解质量和实际的临床意义进行评价。③人群定义不清晰导致无法对数据进行分析。于肿瘤人群而言,患者的病理亚型、既往治疗经历、危险分层、靶点状态/水平等因素都可能影响现有治疗手段的选择和预后判断。部分申请中未对适应症人群进行细分,但现有数据并不能支持其针对全人群的治疗优势; 即使可观察到潜在的优势人群,申请人却未对优势人群进行具体分析。④未提供可靠的历史数据。对于非随机对照研究产生的数据,可靠的历史对照是非常重要的,部分申请中完全未提供对现有治疗手段的数据综述,或仅选择性呈现历史数据。⑤潜在安全性风险影响了临床优势的评价。另有部分申请因为缺乏安全性信息,无法对获益风险比进行预测导致申请失败。⑥无临床研究数据或尚无中国受试者研究数据。当以境外数据作为支持申请的主要数据时,应该对中国受试者中获得有效性和安全性数据与境外数据进行初步的一致性分析。
5 讨论
对获FDA 授予BTD 资质的品种进行回顾性分析的结果表明,BTD 程序初步实现了缩短优势产品的研发周期以及提高其研发成功率的初衷,但BTD 药物是否能给患者带来预期的临床获益,还需要更长时间的观察和更多临床实践的验证。突破性治疗药物工作程序在中国实施伊始即受到广泛关注,抗肿瘤产品是其中最积极的实践者。希望新的加快上市注册程序可以为推动中国新药研发事业注入新的活力和动力,最大程度地造福于患者。
作者|邹丽敏,杜瑜,齐玥丽,唐凌,杨志敏(CDE)
来源|中国临床药理学杂志 2021.06

来源:中国临床药理学杂志


