您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-01 20:58
水在制药行业中扮演重要角色。水的用途包括:清洗;洗手;作为无菌和非无菌水性产品的成分;以及作为高压灭菌器的蒸汽供应等。由于其在药物生产中的重要性,水中的微生物控制就显得尤为重要。由于水的存在,每一种药用水都是潜在的微生物污染源,尤其是在没有适当控制的情况下。控制不仅涉及通过生物负载测试回收的微生物数量,还需要了解水中存在的生物的类型,即对收集到的微生物进行鉴定。建立水系统的微生物检测体系具有重要的意义,不仅可以了解构成不同水系统的最常见微生物分离株,以及不同水质之间是否存在联系,而且通过建立制药用水系统微生物背景数据库,对趋势变化进行分析,从而了解它们是否指示了更严重的问题(例如生物膜)或它们是否对产品(进而对患者)构成特殊风险。本文将从三个方面对制药用水微生物分布结构特征进行剖析:
(1)制药用水的类别;
(2)不同等级用水中的常见微生物分布;
(3)目前的分析方法存在的不足之处。
一、制药用水的类别
制药用水主要包括:饮用水、纯化水和注射用水三个等级。本文将饮用水的水源用水也纳入分析。相比制药用水,不同地区的水源水的水质差异巨大,这种差异主要取决于两个因素:第一个因素是集水区营养情况。这些河流要么是贫营养的河流,要么是营养丰富地区的河流;第二个因素是季节;天然水体中微生物的含量呈季节性分布曲线。
饮用水(Potable-Water):通常为自来水公司供应的自来水或深井水。其质量必须符合国家标准GB5749-85《生活饮用水卫生标准》,含氯。
纯化水(Purified Water):饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用的水、不含任何附加剂。纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制。
注射用水(Water-for-Injection,WFI):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。
二、 不同等级用水中的常见微生物分布
水源水。主要是革兰氏阴性菌。分类多样性水平很高。常见种类包括:铜绿假单胞菌、噬菌蛭弧菌、甲烷单胞菌、黄曲霉和弧菌茎杆菌;革兰氏阳性菌很少,通常是芽孢杆菌属;它是一个完整的生态系统,还包括真菌,原生动物和藻类。
饮用水。水源水经过氯化处理后,微生物的种类的数量都有显著的下降。研究收集了201个水样,鉴定出504个分离株。主要属是革兰氏阴性细菌,排名前十的主要的属见下表。
|
排名 |
属名 |
比率 |
|
1 |
Pseudomonas (假单胞菌) |
24% |
|
2 |
Brevundimonas(短波单胞菌属) |
14% |
|
3 |
Sphingomonas(鞘氨醇单胞菌属) |
9% |
|
4 |
Bacillus (芽孢菌属) |
7% |
|
5 |
Moraxella (卡他莫拉菌属) |
7% |
|
6 |
Micrococcus (微球菌属) |
7% |
|
7 |
Ralstonia (罗尔斯顿菌属) |
6% |
|
8 |
Stenotrophomonas (寡养单胞菌属) |
4% |
|
9 |
Burkholderia (伯克霍尔德菌) |
4% |
|
10 |
Methylobacterium (甲基杆菌属) |
2% |
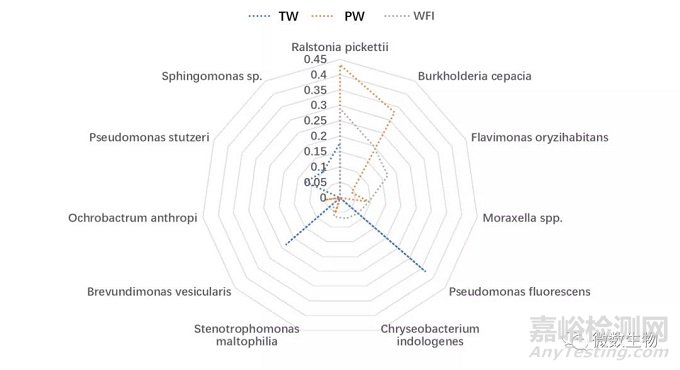
纯化水。生产纯化水的过程是通过反渗透进行的。研究收集了315个样品并回收了347个分离株。最常见的属是“假单胞菌型”微生物,其中最普遍的是Ralstonia(主要是R. picketti这个种)。R. pickettii和B. cepacia绝对是纯净水系统中最常见的分离株。排名前七的主要属见下表。
|
排名 |
属名 |
比率 |
|
1 |
Ralstonia(罗尔斯顿菌属) |
30% |
|
2 |
Burkholderia(伯克霍尔德菌) |
23% |
|
3 |
Pseudomonas (假单胞菌) |
9% |
|
4 |
Moraxella(卡他莫拉菌属) |
7% |
|
5 |
Flavimonas (黄色单胞菌属) |
5% |
|
6 |
Stenotrophomonas(寡养单胞菌属) |
4% |
|
7 |
Ochrobactrum (苍白杆菌属) |
4 % |
注射用水。通常很少从注射用水系统中回收微生物。这是由于生产水的方法(二级反渗透或纯化水蒸馏)和水的分布(通常将水保持在80°C或更高)的性质所致。如果水系统管道设计能避免所谓的“死角”(水流中断的区域)并且保持水流处于持续流动状态,则污染的风险会进一步降低。研究抽取并测试了46,800个WFI样本,收集到439个菌株。收集到的革兰氏阴性杆菌的属列表见下表。该表表明最常见的属是假单胞菌属和与假单胞菌有关的属。就物种而言,频率最高的物种是R. pickettii,其次是Burkholderia cepacia 和Flavimonas oryzihabitans。
|
排名 |
属名 |
比率 |
|
1 |
Pseudomonas (假单胞菌) |
8% |
|
2 |
Burkholderia(伯克霍尔德菌) |
6% |
|
3 |
Ralstonia(罗尔斯顿菌属) |
6% |
|
4 |
Flavimonas(黄色单胞菌属) |
5% |
|
5 |
Moraxella(卡他莫拉菌属) |
4% |
|
6 |
Chryseobacterium(金黄杆菌属) |
3% |
|
7 |
Stenotrophomonas(寡养单胞菌属) |
2% |
|
8 |
Brevundimonas(短波单胞菌属) |
2% |
|
9 |
Sphingomonas(短波单胞菌属) |
1% |
|
10 |
Ochrobactrum(苍白杆菌属) |
< 1% |
总体而言,除去数量的差别,纯化水和注射用水的微生物的种类相比饮用水更为接近(见下图)。
三、 目前的分析方法存在的不足之处
基于水系统及微生物的特殊性,目前对水系统的微生物的检测还有一些不足的地方,主要有四个方面:
(1) 培养基的选择性问题。很多种类的微生物不能培养出来,尤其是Prosthecate bacteria(柄杆菌), Mycobacterium species(分枝杆菌),Spirochaetes(螺旋体),Thiobacillus species(硫杆菌属)等种类。
(2) 采样方式的局限性。目前的采样大多针对自由漂浮状态的微生物,而不是对附着在底层上的微生物或生物膜群落的部分进行检测。
(3) 培养方式的局限性。在制药用水系统中发现的微生物主要是应激的、生长缓慢的菌株,生长前培养时间长。未来需要通过使用中间营养琼脂(如R3A)作为继代培养基;
(4) 鉴定方法的准确性。表型鉴定无法区分R. picketti和R. insidiosa,需要采用基因型鉴定。
本文回顾了制药用水系统微观世界中发现的细菌类型。即使大多数制药用水系统都受到控制,但有时微生物仍会存在,尽管数量很少。因此,作为一般指导,水系统应每年至少进行一次表征,为到达行动限的监控结果提供必要的参考,例如哪些是典型的和预期的微生物。
参考文献:
1. Geldreich EE, Taylor RH, Blannon JC, Reasoner DJ. Bacterial colonization of point-of-use water treatment devices. J Am Water Works Assoc 1985;77(2):72-80.
2. Sandle T. An approach for the reporting of microbiological results from water systems. PDA J Pharm Sci Technol. 2004;58(4):231–7.
Sandle T. Characterizing the Microbiota of a Pharmaceutical Water System-A Metadata Study. SOJ Microbiol Infect Dis. 2015;3(2): 1-8.

来源:Internet