您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-02 21:44
导语:再处理不当的软式支气管镜会引起感染暴发事件,甚至造成患者死亡。应如何评估现有的再处理方案,确保再处理方案是有效的?可采取哪些方法降低感染风险?
背景:感染与再处理不当的软式支气管镜有关,最近的调查表明,即使在支气管镜清洗和消毒操作符合现行指南的情况下,病原体也会传播。这项多点前瞻性研究采用一种系统的方法评估了实际情况下支气管镜再处理方法的有效性。
方法:这项研究包括直接观察软式支气管镜的再处理方法,在手工清洗和高水平消毒后进行多方面评估,以及储存条件评估。使用照明放大镜和管道镜对端口和管腔进行目视检查。使用微生物培养和蛋白质、血红蛋白和三磷酸腺苷(ATP)检测污染。研究人员评估了再处理方法,并通过目视检查和ATP测试来评估存储柜的清洁度。
结果:研究人员检查了24条临床使用的支气管镜。手工清洗后,100%的支气管镜都有残留污染。在14条充分再处理的支气管镜中发现微生物生长(58%),包括霉菌、嗜麦芽窄食单胞菌和大肠杆菌/志贺氏菌。在100%的支气管镜中观察到可见的不规则物体,包括液体滞留、棕色、红色或油性残留物,还发现划痕、插入管和先端部受损以及管道中的丝状杂物。三个医院中有两个医院的再处理方法不合格。
结论:所有研究的医院都在使用受损和污染的支气管镜。不适当的再处理操作可能导致支气管镜上残留生物负荷。然而,即使遵循了指南,高水平消毒也没有效果。建议转向灭菌。同时,需要质量管理计划和更新的再处理指南。
在操作过程中,支气管镜反复暴露于微生物、血液、粘液和其他分泌物中。1这种污染可能会在支气管镜狭窄的管腔和端口内积聚并形成生物膜。2有效的支气管镜再处理方案很复杂,包括床边预清洗、测漏,人工清洗清洗、消毒或高水平消毒(HLD)后再干燥。3-5虽然不遵守再处理指南的情况很常见2,6,7,并且感染爆发通常与违规操作有关,但即使在再处理充分的情况下,也会发生2,8,9支气管镜相关的感染暴发,11在2016年发生的耐庆大霉素阴沟肠杆菌感染暴发事件中,研究人员确认感染传播给了接受超声支气管镜检查的患者,这些支气管镜是根据指南进行了再处理的,但仍携带病原体。12 2016年,其他研究人员报告说,按照指南进行再处理的60%的内镜(包括支气管镜)有微生物生长,研究人员在自动内镜再处理机(AER)的最终冲洗水中发现了水传播的病原体。13
美国食品和药物管理局(FDA)的数据库包含大量与损坏或受污染的支气管镜有关的感染案例。14-20 2015年,在收到109份污染或感染报告后,FDA发布了一份关于与支气管镜相关的微生物传播和感染的安全通报。14该文件敦促医生严格遵守再处理指南,并指出清洗不当可能导致HLD或灭菌失败。FDA还建议修复或更换有损伤迹象的支气管镜,14重申2005年美国胸科医师学会和美国支气管学会的共识声明,即在再处理过程中需要目视检查支气管镜。5如果支气管镜的使用寿命与其他内镜相似,FDA的建议可能具有深远的意义,正如研究人员最近报告的那样,平均19次使用后,100%的输尿管镜出现缺陷,21%和100%的胃肠内镜在使用几个月后会出现缺陷。22最近,Vaidya等人23报告说,超声(EBUS)支气管镜在手术过程中通常会受损,感染是EBUS支气管镜检查后最常见的并发症。这些发现表明,有必要对受损或未经充分再处理的支气管镜的临床应用进行进一步的研究。
本研究的目的是评估实际使用环境下支气管镜再处理的有效性,采用的是系统的、多方面的方法。这包括指南3,4,24中建议的微生物培养和生化试验,这些试验已广泛用于检测内镜上的残留物。21,22,25-31评估包括支气管镜的目视检查、再处理操作的观察以及储藏柜清洁度的评估。
材料和方法
这项前瞻性研究于2017年在美国三家大型三级护理医院进行,其中包括两个移植中心。没有人类受试验者参与。如果机构评审委员会确定该研究不需要评审,每个医院都将该研究定为一项质量改进举措。
根据先前的研究,研究人员预计13,22,25,32污染率为50%或更高,研究人员试图在本研究中评估至少20个支气管镜。为了达到这个样本量,每个试验点必须提供至少4个临床使用的支气管镜,并且鼓励每个试验点使用8到10个支气管镜。研究人员在现场访问期间从手术中相继使用的支气管镜中获取样本。现场人员按照其机构惯例进行再处理。内镜手工清洗和高水平消毒后,研究人员按照严格的无菌技术获取样本。在HLD前后进行的测试揭示了消毒前后有机残留物水平的变化。
从内镜端口和先端部采集样本进行微生物培养,使用无菌、去离子水润湿的无菌拭子,将其放入运输培养皿。采用冲洗-刷-冲洗技术获得管腔流出物样本,22,29,33 将擦拭管腔的拭子和管腔流出物样本放入Dey-Engley中和肉汤培养基中。样本在FDA注册的国际标准化组织认证微生物实验室进行处理,并在28℃至32℃下培养5至7天。对霉菌和革兰氏阴性菌进行菌种鉴定。
根据制造商的三磷酸腺苷(ATP)、蛋白质和血红蛋白的检测说明,对有机残留物进行了现场生化测试。
使用照度计测量来自端口、插入管、先端部和管腔流出物样本中的ATP水平。用分光光度计进行血红蛋白和蛋白质测试。其他研究人员已经验证了这些残留污染测试有效性。29-31,34用于检测活细胞或细胞碎片的ATP测试广泛用于评估内镜上的残留污染。21,22,25-27,32,35-37
为验证取样和检测方法的有效性,将临床使用的胃镜作为阳性对照。无菌材料作为阴性对照。
在对支气管镜进行取样、再处理和储存过夜后,使用摄像机和管道镜进行目视检查。在预先确定的区域,和有不规则现象的区域拍摄照片。
研究人员使用结构化评估表(e-附录1)观察了再处理操作,并记录了指南的遵守情况。3,4,24,38 储存柜清洁度通过目测和ATP测试评估(基准≦250个相对光单位[RLU])。39
分析采用Excel 2016(Microsoft)和SPSS Statistics version 21(IBM)进行。微生物培养结果为每个拭子和每个流出物样品的菌落形成单位(CFU)。用Mann-Whitney和Wilcoxon符号秩检验评价ATP和蛋白质水平。采用Fisher精确检验法检测微生物生长(vs 无生长)。McNemar试验用于确定HLD后微生物生长是否显著减少。蛋白质和ATP水平之间的联系用Spearman相关分析。为了减少I型误差,统计显著性设为P<.01。
结果
研究人员检查了24个临床使用的支气管镜(9个治疗性支气管镜、9个小儿支气管镜、6个EBUS)和2个新的治疗性支气管镜,这2个支气管镜都没有使用过或再处理过。各个区域支气管镜使用时长类似(4.0年;范围0.9-11年;P=.947)。获得20个支气管镜清洗后和HLD后的成对样本(表1,表2)。
表1.临床使用的支气管镜手工清洗后发现的有机残留物和微生物

CFU=菌落形成单位
EBUS=超声支气管镜
ID=编号
N/A=不适用
Ped=儿科
RLU=相对光单位
Thera=治疗
TNTC=太多难以计数
a器械端口样本的表面CFU;插入管先端部的采样
b和自来水相关的微生物
表2.临床使用的支气管镜高水平消毒后发现的残留有机物和微生物
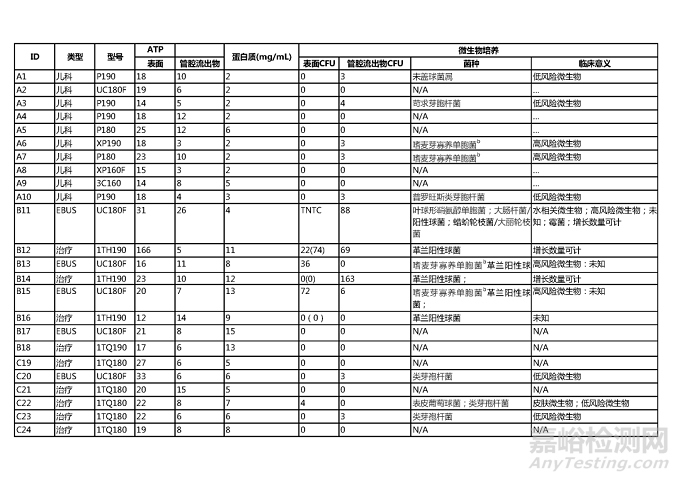
缩略词释义见表1
a器械端口样本的表面CFU;插入管先端部的采样
b高风险微生物:和疾病相关的微生物;已知病原体或潜在病原体如革兰阴性杆菌63
在手工清洗后和高水平消毒后100%的支气管镜样本中检测到蛋白质(表1,表2)。HLD后样本的蛋白质水平显著高于阴性对照组(P<0.001),与阳性对照组相当(P¼.36)。在1(5%)手洗支气管镜(C24,1mg/mL)上检测到血红蛋白,没有在HLD后支气管镜或阴性对照受试者身上检测到血红蛋白。阳性对照受试者的血红蛋白水平在0到3 mg/mL之间。在手工清洗后,表面的ATP水平中位数为31 RLU(范围,17-170 RLU);管腔流出物为26 RLU(范围,4-220 RLU)。在HLD后,表面的中位数ATP水平为20 RLU(范围,12-166 RLU);管腔流出物为8 RLU(范围,3-26 RLU)。HLD后表面ATP水平明显高于阴性对照组(P<0.001)。HLD后的出管腔流出物ATP水平与阴性对照组相当(P¼.014)。HLD后的ATP水平显著低于手工清洗后的水平(管腔流出物,P<.001;表面,P=.001)。
在20个(55%)手工清洗的支气管镜(A,20%;B,100%;C,83%)中的11个和24个(58%)HLD后支气管镜(A,50%;B,75%;C,50%)的14个样本中发现微生物生长(表2)。高水平消毒后的支气管镜中发现的微生物包括环境细菌和普通菌群如芽孢杆菌属、表皮葡萄球菌属)以及常见的病原体(如嗜麦芽窄食单胞菌、大肠埃希菌/志贺氏菌属)和霉菌(莱卡菌/大丽叶黄萎病)。阴性对照受试者的结果表明,研究人员在取样期间保持了无菌条件,阳性对照受试者的高水平微生物生长证实了在运送到实验室期间采样的可行性。
在C点,研究人员对两个仍然装在集装箱中的新的支气管镜样本进行了测试。在首次的手工清洗之前或之后,一个支气管镜的样本中没有检测到污染。在另一个新的支气管镜中,首次手工清洗前未发现微生物,但ATP、血红蛋白和蛋白质水平低。在这台新的支气管镜进行第一次人工清洗后(临床使用前),重新测试发现蛋白质水平增加了4倍(从4毫克/毫升增加到17毫克/毫升),并在样品中发现细菌生长(拟杆菌属;8 CFU)。
研究人员观察了所有临床使用的支气管镜的不规则情况。外部检查发现油性残留物;干燥的液体斑点;棕色、红色和白色残留物;划痕;插入管弯曲;先端部受损(图1)。内部检查发现液体、变色、划痕、丝状碎屑和管腔有凹痕(图2、3)。支气管镜使用时间、研究部位和不规则性之间似乎没有关联。
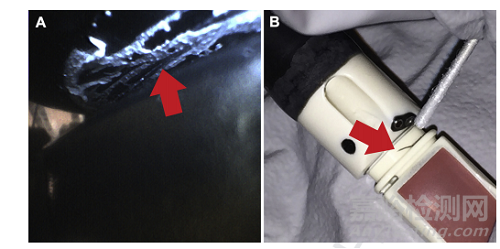
图1–准备好给患者使用的支气管镜上有残留的碎屑。
A、 支气管镜旋转控制环下的白色残留物。
B,从超声支气管内镜气圈环上用无菌拭子去除的棕色残留物。
研究人员无法用拭子完全清除残留物。箭头指示残留物的位置。

图2-A,新的支气管镜管腔,与之相比,准备好给患者使用的支气管镜管腔有(B)凹痕、(C)残余液体和(D)丝状碎屑。(B)、(C)和(D)中的箭头表示观察到的不规则的位置

图3-A和B,新的支气管镜(A),与之相比,准备好给患者使用的支气管镜导管分叉处有白色、棕色、锈迹斑斑(B)。箭头指向管腔中大致相同的位置。
在A点观察到的支气管镜再处理、干燥和储存方法符合或优于国家指南(表3)。测漏采用自动化系统进行,支气管镜由技术人员按照国家标准穿戴个人防护装备(PPE)在去污室手工清洗。蛋白质、血红蛋白和碳水化合物测试被用来验证清洗效果。未通过要求的支气管镜被重新清洗并重新测试。支气管镜通过窗口送入洁净室进行自动清洗,并在自动内镜再处理机(AERs)中使用过氧乙酸进行HLD。
表3.现行内镜再处理指南的遵从性概览

HLD=高水平消毒
PPE=个人防护装备
a符号:ü符合现行指南
-:不符合现行指南
高水平消毒后,自动内镜清洗机用酒精冲洗管腔然后用加压空气干燥。然后,技术人员用10分钟的医用加压空气干燥管腔,并用干净的无绒布擦拭外表面。支气管镜用干净的容器运输,并垂直存放在密闭的柜子里,柜子里有过滤空气。储存柜肉眼下是干净干燥的。
B点和C点支气管镜再处理、干燥和储存的方法不符合国家指南或制造商的使用说明,技术人员未穿戴适当的PPE。在B区,支气管镜在去污室进行了粗略的测漏和手工清洗。在C点,没有进行测量试验,在去污室中手工清洗期间,没有使用清洗剂冲洗管腔。在AERs(Advantage Plus;Medivators Inc.)过氧乙酸HLD之前,现场均未进行清洗验证或目视检查。高水平消毒后,工作人员用酒精冲洗管腔并用加压空气干燥。B点的工作人员表示,为了节省时间,他们的AER自动清洗循环已被禁用。现场C的工作人员表示,他们跳过了部分手工清洗步骤,因为AER有自动清洗循环。
从AER取出后,工作人员用重复使用的脏毛巾擦拭B点的支气管镜。之后干燥端口和管腔15秒,然后用气枪干燥,然后徒手将其运至储藏室。技术人员戴着同一副手套来处理所有类型的人工清洗内镜、装卸AER、干燥和运输内镜。没有观察到手卫生,技术人员报告说,他们只在休息前洗手。支气管镜垂直悬挂在装有风扇(但没有使用)的柜子里。内镜柜很脏,底部和墙壁上有灰尘和污渍。观察到再处理技术人员和护理人员徒手拿取准备好给患者使用的支气管镜。
在C点,支气管镜从AERs取出后,通过窗口送入清洁区。然后,再加工技术人员重复使用注射器,用一天中储存在无盖不锈钢碗中的酒精冲洗管腔。支气管镜用重复使用的毛巾擦干,用一支没有压力调节功能的气枪干燥管腔。支气管镜垂直存放在一个没有通风功能的柜子里,柜子位于手术室的走廊里。这个柜子满是灰尘,凌乱不堪,用来存放其他用品。观察到护理人员徒手拿取准备好给患者使用的支气管镜。
AER滤水器在所有位置都明显变色。A和B点的工作人员表示,过滤器已按照使用说明进行了更换,研究人员的观察了记录证实这。C点的滤水器未在制造商规定的时间内更换。
ATP测试显示,每个点的存储柜的表面RLU都超过了制造商规定的250-RLU基准。ATP读数最高的样本来自B和C点的存储柜底部(分别为4219和513 RLU)和A站点的机柜内壁(900 RLU)。
讨论
这项实际的前瞻性研究发现,在三家三级护理医院准备好给患者使用的软式支气管镜100%都有可见的缺陷,58%有微生物生长。HLD后支气管镜检查发现致病菌,包括嗜麦芽杆菌和大肠杆菌/志贺氏菌。此外,从三个准备好给患者使用的支气管镜样本中发现超过100个CFU。目前的指南认为,无论发现的物种是否是病原体或潜在病原体,这种生物负荷水平都是可接受的。40-43由于研究没有涉及评估患者或审查医疗记录,因此对患者的临床意义尚不清楚。然而,结果令人担忧,因为接受支气管镜检查的患者通常由于移植状态、危重病情或恶性肿瘤或慢性病免疫低下而有较高的感染风险。据报道,受污染的支气管镜已经有引起的感染性暴发和病人死亡2,8-11,44,由于支气管镜中的生物负荷而引起的假暴发或假阳性培养结果同样具有毁灭性,因为存在不必要的治疗风险。在这项研究中,从支气管镜取样的样本中发现了铜绿假单胞菌和嗜麦芽乳杆菌。美国食品和药物管理局最近报告了一起支气管镜检查导致5名患者感染这些病原体的感染暴发,其中三名患者死亡。44
在研究地点,支气管镜上发现的污染源是未知的,有几个潜在的污染管腔。考虑到患者群体,以及3个研究点中有两个再处理水平较低,手术过程中直接接触病原体是很常见的污染原因。所有研究点都有使用受损的支气管镜,先前的研究表明,损坏的内镜表面可能会促进生物膜的形成。2,45本研究在C点对新的支气管镜进行的测试结果表明,在人工清洗过程中污染物被引入支气管镜,因为初次清洗后(临床使用前)检测到微生物的生长和高水平的蛋白质。污染环境表面的交叉污染可以解释支气管镜中胃肠道细菌的存在,因为所有医院用来处理支气管镜的AERs也用于处理胃肠道内镜。站点B故意禁用AER以节省时间(每个周期大约20分钟)。这可能会对再处理效果产生负面影响,并可能促进生物膜在AER中的积聚。研究方案不包括进行额外的测试来评估这种违规操作的影响,需要进一步的研究来确定AER禁用的比例和影响。
所有地点的空气过滤器都明显变色。与清洗后的支气管镜相比,A点培养结果显示HLD后支气管镜有微生物生长的比例更高,现场人员更换了AER滤水器,并在滤膜和滤水罐中发现霉菌和棕色污泥。这可能会阻止过滤器正常工作,并导致污染物在最后的冲洗循环中进入AER。以前曾报道过AERs对内镜的污染。9,13,46随着AER过滤器更换频率的增加,与支气管肺泡灌洗相关的鸟分枝杆菌复合物的假爆发结束。研究人员得出结论,AER过滤器应根据再处理量进行更换,而不是根据制造商基于运行时间所做的建议。47在本研究中,对C点新支气管镜进行的试验结果表明,在人工清洗过程中,污染物会进入支气管镜,因为最初的清洗后检测出微生物和蛋白质。储存条件也可能会污染再处理后的支气管镜,3因为目视检查和ATP测试结果表明储藏柜不干净。其他研究人员最近报告说,储藏柜内的沉降板上以及从再处理后的十二指肠镜中提取的样本中检测到类似的细菌。48目前的指南建议定期清洁储藏柜,以降低再处理后的内镜再次污染的风险。3,4,24,49此外,观察到B和C点的护理人员徒手搬运和运输准备好给患者使用的支气管镜,这可能使支气管镜暴露在污染物中。
由于研究人员在这项研究中观察到一系列严重的再处理违规操作和损坏的支气管镜的使用,支气管镜再处理的常规审核和维护是有必要。目前的准则建议由专家进行定期审计,以确保再处理操作是充分的。研究人员在本研究中使用的审计表(e-表1)评估了基本步骤的类别,疾病控制和预防中心的医疗感染控制实践咨询委员会提供了更全面的审计和技术人员能力评估工具。50
在现场考察期间,研究人员询问了支气管镜表面观察到的油性残留物的潜在来源。现场人员表示,医生通常在手术过程中使用硅酮喷雾剂作为润滑剂。所有地点都在使用含有硅酮的非水溶性润滑剂和消泡剂。这些产品不是无菌的,标签上也没标明适用于软式支气管镜。内镜制造商建议在使用硅基润滑油时要注意,因为再处理可能无法去除这些物质。51这些类产品与内镜中生物膜的形成有关。52,53
为解决研究期间发现的问题而采取的措施因地点而异,包括再培训、更换损坏的支气管镜、更换空气过滤器和冲洗管道系统、改用灭菌以及使用一次性无菌支气管镜。感染控制专家协助评估患者暴露风险并制定策略降低风险。
正如2005年关于预防软性支气管镜检查相关感染的共识声明中所指出的,许多支气管镜使用人员“可能理所当然地认为他们使用的器械是安全的。”5我们的发现和其他团队的研究表明,当支气管镜损坏或脏污时,HLD是无效的。3,4,24,54,55因此,按照国家内镜再处理指南的建议进行目视检查和清洗验证是至关重要的。3,4,24为减少患者接触受污染的支气管镜,机构应考虑从HLD转向灭菌。1995年,Seballos等人56指出,克利夫兰诊所的支气管镜正在用过氧乙酸消毒,因为在软性支气管镜检查过程中进行的活检量很大,接受支气管镜检查的免疫受损患者越来越多,以及为了“尽量减少公众对器械传播感染风险的担忧”等原因。可重复使用的软式支气管镜目前可用环氧乙烷气体57-59或过氧化氢气体灭菌。目前需要60,61前瞻性研究来评估支气管镜灭菌的有效性以及重复灭菌对支气管镜耐久性的影响。当灭菌方法不能获得或无法操作时,医疗机构可以将支气管镜再后处理和胃肠内镜再处理分开来降低风险。在无法分开胃肠和支气管镜再处理的机构或无法保持高水平的再处理质量的情况下,可使用无菌一次性支气管镜来确保患者安全。
微生物培养结果可能低估了生物负荷量,因为只使用两种类型的琼脂板进行培养,而且由于没有资源支持较长的培养期,因此没有对样本进行分枝杆菌检测。62此外,许多培养皿生长出产芽孢细菌或霉菌,在生长过程中比其他微生物更具竞争力。因此,最终平板检查时出现的菌落可能并不代表原始样品中存在的所有微生物。没有足够的资源来鉴定所有的细菌菌落,而且革兰氏阴性菌的鉴定是优先考虑的,因为指南将它们定义为高风险细菌。3,4本研究中发现的革兰氏阳性菌缺乏物种鉴定,这可能低估了潜在病原体的流行率。此外,还没有进行检测乙肝、丙肝或流感等病毒的测试。尽管有这些局限性,但大多数准备好给患者使用的支气管镜中存在可培养的活菌,这表明目前的再处理方法存在缺陷。也许更紧迫的是,需要对污染支气管镜的临床意义有更深入的了解。
结论
这项前瞻性的多点评估发现,即使按照内镜再处理指南进行,目前的支气管镜再处理方法也是无效的。多种因素可能会影响生物负荷的残留,需要进行系统的改变以改进清洗和消毒方法。需要循证的支气管镜再处理和维护指南,以及质量管理计划,以确保这些复杂过程的有效实施。转向灭菌或一次性使用的支气管镜可以降低易受感染的患者群体的感染传播风险。

来源:鲁沃夫CSSD国际论坛


