您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-11 21:51
ECMO(Extracorporeal membrane oxygenation,体外膜肺氧合)是一种生命支持类设备,也是一种改良形式的体外循环,可为常规治疗无效的呼吸衰竭患者提供临时的气体交换支持,足够的组织氧气输送,其主要适应症之一即为急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)的患者,也可作为肺移植的桥梁。ECMO可分两种类型,静脉动脉VA和静脉静脉VV,两者都能提供呼吸支持,但只有VA ECMO能提供血流动力学支持。
ECMO设备由许多部件组成,一个标准的回路包括磁悬浮离心泵、气体交换装置和热交换装置、主机,以及连接这些部件与患者间的管路。ECMO回路由简单到复杂不等,可包括各种血流和压力监测设备、连续氧合血红蛋白饱和度监测器以及各类定制的桥接管路,让患者在相对较长一段时间内(数天至数周)得到支持,其主要治疗目的是桥梁而非终点。
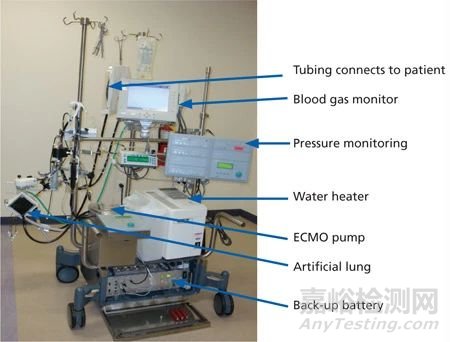
图1. ECMO机器的各个部件(静脉血从患者体内排出,通过静脉饱和度传感器和储存袋,被泵入氧合器/热交换装置,随后含氧温热的血液再通过ECMO回路桥,输送回患者的动脉或静脉系统,沿途有多个压力及流量监测器)
ECMO回路必须涂覆具有生物相容性的内衬(譬如硅酮,胆碱酯酶,等等),以减少全身炎症反应,血栓形成和出血的风险。但截至目前,暂无任何涂层可完全消除这类并发症。回路中可包含多个监测器,包括测量总回路血流量和独立的静脉、动脉超声测量器,其中三个重要位置需测量压力,包括离心血泵前,防止过度抽吸;及气体交换装置前和后,氧合器前后(跨膜)的压力差增加,提示氧合器内部的阻力增加。
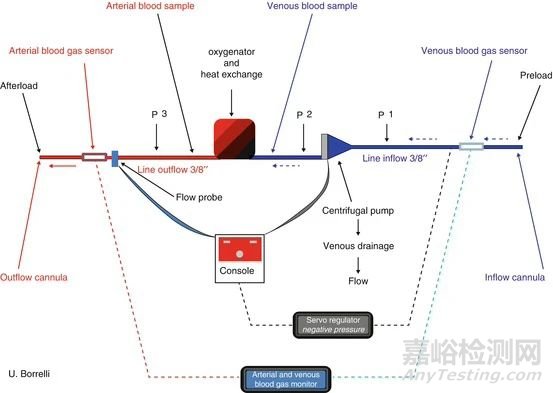
图2. 成年患者ECMO回路的示意图
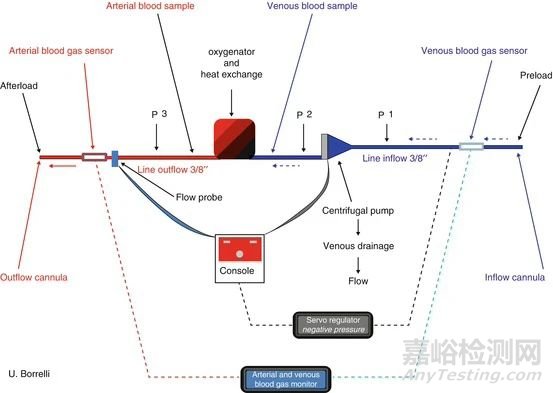
图3. ARDS患者VV ECMO支持后,相关并发症和死亡率的情况
不过说到ECMO,到底不能不提的还是膜肺(Membrane Oxygenator)。在膜肺出现之前,气泡式氧合器(将血液直接暴露在大气中,容易导致血液损伤和血液丢失)是主要使用的器械。1944年,Williem J. Kolff教授和H. TH. J. Berk(一家陶瓷公司的董事)发现微孔玻璃纸具有半渗透性,能够传输氧气,他们开创了肾透析治疗,并同时开启了对膜肺的初步研究。第一个成功的膜肺由Clowes等人于1955-1957年间开发,使用25微米的聚乙烯薄膜,对氧气和二氧化碳的渗透率低但稳定,并具有很大的表面积,后期改进为堆叠的乙基纤维素膜,但乙基纤维素允许水渗入,脆性材料机械支撑力差,且气压过大常导致回路内栓塞。随着生物相容性较好的有机硅的发现,其表现出稳定的结合、低表面张力和无毒性,被证明是医疗器械应用的极佳材料。1969年,Galletti及其同事使用10微米的硅胶薄膜覆盖微孔基材。随后,为了克服涤纶和玻璃纤维网支撑的76微米厚硅胶膜中的材料缺陷,及由此产生的气体栓塞,Kolobow等在螺旋缠绕式平行板膜肺中使用了低压氧气,以降低跨膜氧分压梯度为代价,显著提升了膜肺的安全性。膜肺的路径特点直接影响了转移到血液中的气体量,因此这一阶段每个制造商都通过各种创新来力求达到这一目标。

图4. Kolff博士于1944年制作的,首次获得临床成功的人工肾(都是膜~)
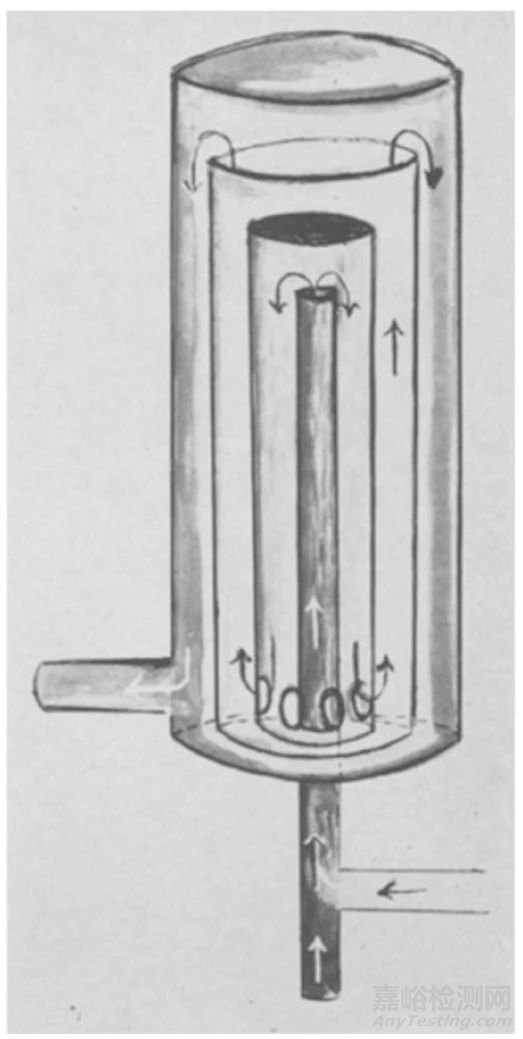
图5. 1965年发明的Rashkind膜肺

图6. Kolobow圆柱形膜肺(A)硅胶涂层涤纶筛网,带有用于气体交换膜的玻璃纤维支撑筛网;(B)组装后的膜肺

图7. 1960年代市售的膜肺,(A)Lande-Edwards和(B)Travenol儿科膜肺,利用有机硅共聚物膜片形成一叠平行板,使用带槽塑料支撑控制血道高度,大大提升了气体交换率,简化了临床操作,多个膜肺还能并行使用
透气膜是膜肺的重要组成部分,半个多世纪以来,膜的制造和包装技术取得了显著进步,呼吸生命支持器械的使用因此而更安全和持久。1971年,第一台中空纤维膜肺诞生,血液分散通过各根10-18厘米长的微孔(直径小于1微米)聚丙烯中空纤维管,气体则在这些纤维管外流动,从而达到了既往无法企及的高气体交换,也减少了与硅酮相关的凝结问题。然而,这也带来了新的挑战,血浆可逐渐渗入微孔并抑制气体转移(血浆渗漏,使用后8小时即可发生),血液中的磷脂可非特异性地结合到纤维,在微孔开口处形成亲水表面,随后血浆即可通过毛细管作用渗入空隙,并使得磷脂进一步结合。这一过程后,由于与空气相比氧气在水中的扩散率低得多,气体传输随之大大降低,此时的膜肺寿命有限并需经常更换。为解决这一问题,Kawahito等探索了使用硅橡胶材料的纤维,疏水性的硅橡胶可防止水进入微孔,但它的气体交换率较低。
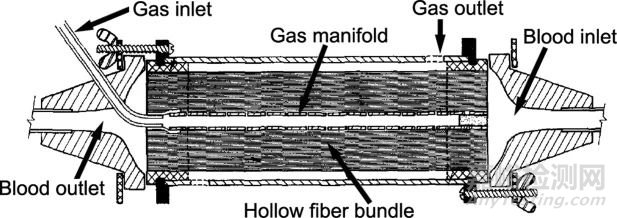
图8. 现代膜肺示意图

图9. 单根中空纤维管表面的扫描电镜照片,可见直径小于1微米的微孔在膜的气体和血液侧之间形成直接通道
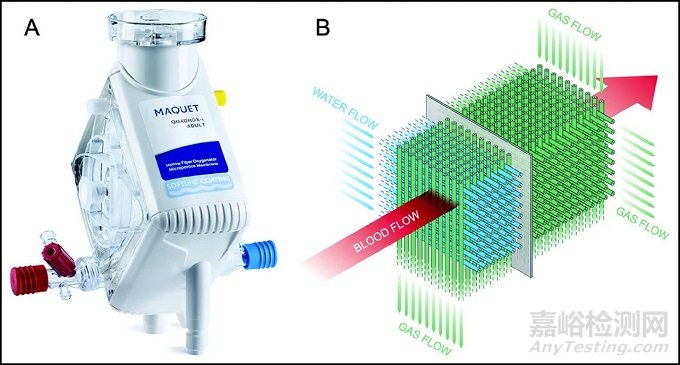
图10. Quadrox-iD(Maquet)是第一款所谓的等离子膜肺,其纤维束采用独特的交织排列,并具有相互垂直的血液、气体和水通道,因此气体和温度的传输速率更高
终于到了世纪之交,我们迎来了一种新型的膜材料聚甲基戊烯(Polymethylpentene,PMP),它不但具有对氧气和二氧化碳扩散的最小阻力,还提供了一种不透水表层微孔结构,解决了等离子体渗透微孔的问题,更具生物相容性且可使用更长时间。临床上最常使用时间已达到59天,目前,美国超过90%的中心倾向使用PMP膜肺。

图11. 现代的PMP膜肺(离不开3M公司啊)
今天的最后,世卫组织临时指南建议,向符合条件的COVID-19相关ARDS患者提供ECMO支持,下图即为体外生命支持组织(ELSO,Extracorporeal Life Support Organization)提供的全球ECMO储存量,在可预见的将来,ECMO的储备和使用也将越来越多、越来越广。
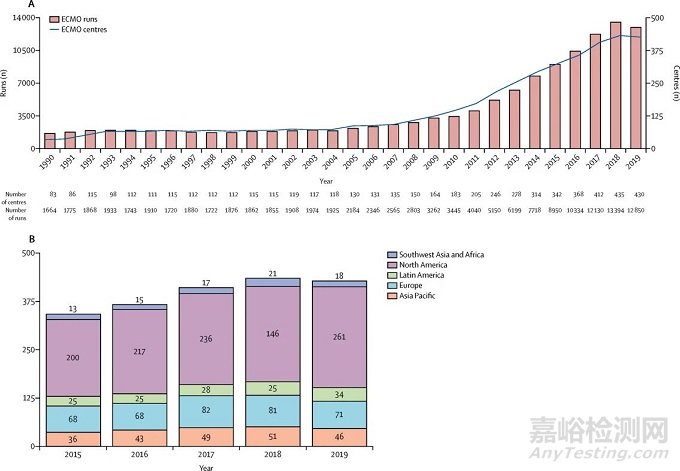
图12. ELSO提供的全球ECMO储存量
引用文献:
1. Kollengode Ramanathan, David Antognini, Alain Combes, et al. Planning and provision of ECMO services for severe ARDS during the COVID-19 pandemic and other outbreaks of emerging infectious diseases. Lancet Respir Med 2020; 8: 518-26.
2. Richard W. Melchior, Steven W. Sutton, William Harris, et al. Evolution of membrane oxygenator technology for utilization during pediatric cardiopulmonary bypass. Pediatric Health, Medicine and Therapeutics 2016: 7, 45-56.
3. Laurance Lequier, Stephen B. Horton, D. Michael McMullan, et al. Extracorporeal membrane oxygenation circuitry. Pediatr Crit Care Med. 2013 Jun; 14(501): S7-12.
4. George Makdisi, I-wen Wang. Extra corporeal membrane oxygenation (ECMO) review of a lifesaving technology. J Thorac Dis. 2015 Jul; 7(7): E166-E176.

来源:MiHeart