您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-13 22:05
前 言
全身毒性是医疗器械使用中的一种潜在的不良反应,可由于器械或材料可沥滤物的吸收、分布和代谢到达不与之直接接触的人体部位而产生一般毒性作用,以及特异性靶器官和器官全身毒性作用。本简介只涉及一般全身毒性评价。
定 义
亚急性全身毒性:在24h-28d内多次或持续接触试验样品后发生的不良作用;亚急性静脉研究一般规定接触时间>24h,但<14d。
亚慢性全身毒性:反复或持续接触试验样品后在动物寿命周期的某一阶段发生的不良反应;亚慢性静脉研究一般规定接触时间为14d-28d。
慢性全身毒性:在动物的主要寿命周期内反复或持续接触试验样品后发生的不良作用。
测试项目的选择
哪些医疗器械需要做重复接触毒性测试,以及需要做哪些测试项目呢?大家可以参考下方的表格:
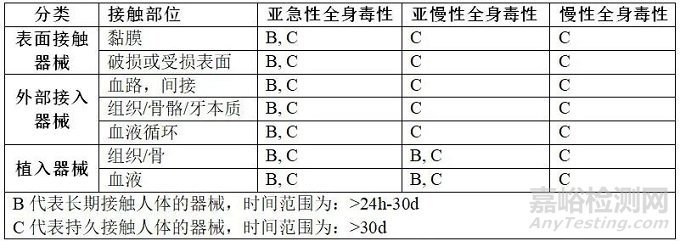
如果产品中不含新材料,那么可以通过论证来评价产品的慢性全身毒性作用,慢性全身毒性试验就可以不需要做了。反之,如果产品中含有新材料,那么产品的慢性全身毒性试验是必须要做的。
测试方法及观察指标
由于医疗器械及其材料和应用范围种类繁多,在设计全身毒性试验时要考虑到具体的方法学,适当的研究设计必须与器械材料的特征及其预期临床应用相适应。因此,选择接触途径时应该采用最接近临床使用的途径,比如皮肤、植入、吸入、皮内、肌内、腹腔、静脉、经口、皮下等,下面来介绍最常见的植入途径和腹腔/静脉途径,以下两个表格分别是植入途径测试方法和腹腔/静脉途径测试方法,动物模型为大鼠。
植入途径

植入途径需要提供产品在临床应用中在特定的时间范围内与人体重复接触的可能的最大量,例如某一个植入物单个重量为100g,临床使用中最大5个,那么最大剂量为500g。试验剂量推荐为在动物可耐受情况下的50-100倍,该接触倍数来自中国器审中心-共性问题解答,具体请见下图:

腹腔/静脉途径

结果评价
对重复接触实验中的发现宜结合以前的研究发现、毒性作用方面的考虑及尸检与组织病理学方面的发现进行评价。评价包括:
1)测试组和对照组动物体重和饲料(水)消耗量之间差异;
2)日常临床观察周期内有无行为异常和毒性迹象;
3)临床病理学检查中,测试组和对照组血液学或临床化学检查数值有无统计学差异;
4)大体病理检查中,器官是否正常,是否存在异常变化;
5)组织病理学检查中,测试组和对照组组织切片是否有明显差异。
根据以上研究判断医疗器械是否存在重复性接触毒性反应,若以上指标测试组和对照组无明显差异,则检测样品不存在重复性接触毒性反应。

来源:海河生物


