您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-02 16:29
长期以来,医疗器械的验证和确认都困扰着大家。今天,我们就跟大家分享一下,并就大家关心的验证与确认问题进行归纳总结,供朋友们参考。
◆◆一、验证和确认的定义与区别◆◆
01根据《医疗器械生产质量管理规范》,分别定义如下:
验证(verification)指的是通过提供客观证据,对规定要求已得到满足的认定。
确认(validation)指的是通过提供客观证据,对特定的预期用途或应用要求已得到满足的认定。
02在设计开发阶段:
设计验证和设计确认是设计开发过程的重要阶段,法规中有着明确的要求。
设计验证指的是企业应当对设计和开发进行验证,以确保设计和开发输出满足输入的要求。
设计确认指的是企业应当对设计和开发进行确认,以确保产品满足规定的使用要求或者预期用途的要求。
03在生产阶段:
验证:企业应当对关键工序重要参数进行验证。其中关键过程指的是对产品质量起决定性作用的工序。
确认:企业应当对生产的特殊过程进行确认。当生产和服务提供过程的输出不能或没有被后续的监视或测量加以验证时,缺陷在产品使用中或服务已交付之后才会显现。确认应能证实这些过程持续实现所策划的结果的能力。
常见的验证和确认项目

◆◆二、两者的区别◆◆
验证和确认主要表现在对象不同;方法不同;结果不同。
1、验证针对的是结果,确认针对的是过程;验证采取的方法通常是试验法,确认采取的是系统的方法;
2、验证的结果是证实被试验的对象在某一条件下符合规定的要求。确认的结果是证实运用该过程可以在某个范围内持续产生符合要求的输出。
3、验证常用于操作规程(或方法)、生产工艺或系统,如性能验证、有效期验证、纠正措施验证;确认通常用于厂房、设施、设备仪器及特殊过程;
验证和确认紧密联系却又和而不同
验证要保证“设定的指标达成”,而确认则要保证“做的产品管用”;
验证注重“过程”,确认注重“结果”;
验证是自我视角,确认是客户视角。
验证与确认对比表
|
验证 |
确认 |
||
|
定义 |
通过提供客观证据,对规定要求已得到满足的认定 |
通过提供客观证据,对特定的预期用途或应用要求已得到满足的认定 |
|
|
对象 |
针对的是过程 |
针对的是结果 |
|
|
方法 |
内部:功能性能测试 外部:检测所送检 |
内部:组织医生或病人试用 外部:临床试验、评价 |
|
|
结果 |
证实被试验的对象在某一条件下符合规定的要求 |
证实该过程在某范围内持续符合要求 |
|
|
设计开发阶段 |
设计和开发输出满足输入的要求 |
产品满足规定的使用要求或者预期用途的要求 |
|
|
性能验证、方法学验证、工艺验证、有效期验证、稳定性验证包装与运输验证、注册检验等 |
临床评价为主(临床试验、免临床和同品种对比) |
||
|
生产阶段 |
对关键工序进行验证 |
对特殊过程进行确认 |
|
|
关键部件安装、调试、包装等,各种效果验证,如消毒、清洗、纠正措施等 |
焊接、热熔、灭菌、注塑、封口等 |
||
|
设施设备 |
自行设计的工装设备要进行验证 |
按照GHTF过程确认指南进行安装确认、运行确认和性能确认 |
|
|
软件 |
/ |
采用的计算机软件对产品质量有影响的,应当进行验证或确认。 |
|
|
再验证再确认 |
有下列情况之一时须进行再验证或再确认: |
||
◆◆三、常见确认项目的要点◆◆
01GHTF中的过程确认
其包括以下三个步骤:
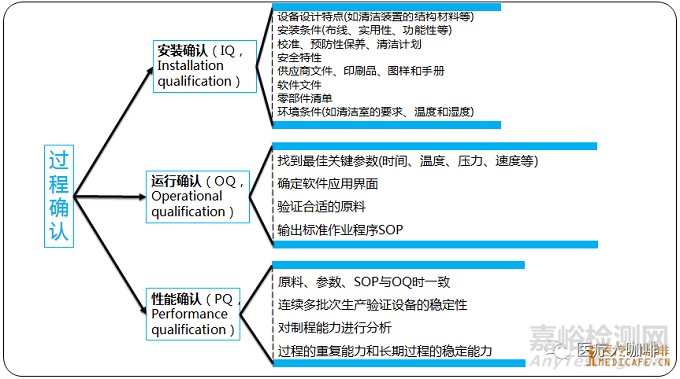
▲安装确认(IQ):有客观证据支持,即正确地考虑到所有符合厂商规格的过程设备和辅助安装系统的主要布置和设备供应商的说明。
IQ考虑事项包括:设备设计特点(如清洁装置的结构材料等)、安装条件(布线、实用性、功能性等)、校准、预防性保养、清洁计划 、安全特性 、供应商文件、印刷品、图样和手册、软件文件、零部件清单、环境条件(如清洁室的要求、温度和湿度)
有时候,活动的实施是发生在设备供应商处、设备发运前的。设备供应商可在他们的机构内(对设备)进行测试并分析结果,以决定该设备的发运。供应商鉴定资料的拷贝应用作指导文件,以获取基础数据和补充安装鉴定。但是,仅立足设备供应商的确认结果往往是不足够的。每个医疗器械厂商基本上要负责评估、质疑和测试该设备并判定该设备是否能适用于生产特定的器械。该评估可能会引起对设备或过程的修改。
▲操作确认(OQ):有客观证据支持,即使产品符合所有预定要求的过程控制范围和作用程度。
这个阶段,过程参数应不断被调整以保证能产出一个在预定生产条件下的,符合所有规定要求的产品,如(进行)最坏情况测试。在日常生产和过程控制当中,需要做的是测量过程参数和/或产品特性以促进在各个作用程度上对生产过程进行调整,并保持一个控制状态。为判定过程强度并防止趋向最坏情况条件,应对这些作用程度进行评估和确立,并形成文件。
OQ考虑事项包括:过程控制范围(时间、温度、压力、线速度、启动条件等) 、软件参数 、原材料规格、过程操作程序、材料处理要求、过程修改控制、培训、短期稳定性和过程能力、可能的故障状态、作用程度和最坏情况条件、统计学有效技术的使用,如采取筛选试验来规定主要过程参数,采取统计学试验设计来优化过程,使其能在这个阶段中使用。
▲性能确认(PQ):有客观证据支持,即在预期条件下,过程连续地产出符合所有预定要求的产品。
PQ考虑事项包括:OQ阶段的真实产品、过程参数和建立的程序、产品的可接受性、如OQ阶段建立的对过程能力的保证、过程的重复能力和长期过程的稳定能力。
过程调整应模拟真实生产条件下碰到的情况。调整应包含如在OQ阶段建立的,通过书面标准操作程序允许的作用程度所确立的条件范围。该调整应重复进行足够的次数以保证结果的意义和一致性。
应对过程和产品数据进行分析,以决定和过程输出相对应的变化的正常范围。了解输出的正常变化对于决定过程是否在控制状态下操作和能否连续产生规定输出是相当关键的。
OQ和PQ的输出之一是使连续监控和(设备)保养的好处得到发展。同时,应分析过程和产品数据,来确定任何可以通过可控制原因进行调整的变化。依过程性质和其灵敏性而定,可控制原因包括了:温度、湿度、电源改变、振动 、环境污染 、加工水的纯度、光线 、人的因素(培训、人机工程学因素、压力等等)、材料的可变性、设备的磨损和破坏
应采取适当的措施来消除引起变化的可控制原因。消除引起变化的可控制原因将减少过程输出的变化和形成更强的保证力度来保证输出一致符合规格。
3Q要素一览表
02确认的关键参数一览
针对进行灭菌、工艺用水、工艺用气、封口、清洗等常见的确认项目,韩老师根据法规要求对确认关键参数和要点进行汇总整理,具体详见下表。
常见医疗器械3Q确认要点一览表
|
项目 |
过程 |
关键参数与要点 |
|
灭菌确认 |
安装确认 |
1)设备供应商资料(营业执照、生产许可证、医疗器械注册证等) |
|
运行确认 |
1)灭菌柜柜壁、空间温度均匀性; |
|
|
性能确认 |
1)物理性能鉴定:在规定预处理(如有)时间结束时,被灭菌物品处于预处理规范规定的温度和相对湿度范围内;加入蒸气时温度与压力升高的关系;向灭菌器室内加入灭菌剂时,被灭菌物品的温度和湿度在灭菌过程规范规定的范围内;气体灭菌剂已经加入灭菌器室内;温度和湿度及其他适用参数处于灭菌过程规范规定的范围内;在整个作用时间内,被灭菌物品保持在规定的物理条件(包括EO浓度、压力、湿度、温度)下;在通风过程中,被灭菌物品保持在规定的温度范围内;通风后EO和其反应产物的残留水平应低于规定的限度。 |
|
|
其他 |
灭菌确认完成后,还应对灭菌过程对产品其它性能(如化学性能、物理性能、生物相容性等)的影响进行确认,以确定该灭菌过程适宜于其产品。 如需要重复灭菌的,还应对重复灭菌情况进行确认,包括灭活确认、其它性能确认(如化学性能、物理性能、生物相容性等)。 |
|
|
工艺用气 |
安装确认 |
1)压缩空气系统的制造商、品牌、型号、序列号或设备识别号(固定资产号)、安装位置、压缩空气系统的组成及配置。 |
|
运行确认 |
1)确定压缩空气系统的关键参数和接受标准,如露点(水分)、油分、尘埃粒子和微生物等。标准应当符合设计要求;尘埃粒子和微生物指标应当不低于其使用环境的洁净度级别。 |
|
|
性能确认 |
1)本阶段应当在正常使用和运行参数下,对总送气口及所有使用点进行测试。测试应当进行三次,每次至少间隔8小时,以确认压缩空气系统的稳定性和可靠性。测试包括露点(水分)、油分、尘埃粒子和微生物,测试结果应当符合标准要求。测试点应当在工艺流程图P&ID图上标注。 |
|
|
再确认 |
再确认是指一项生产过程、一个系统(设备)或者一种原材料经过验证并在使用一个阶段以后,为证实其验证状态没有发生漂移而进行的确认。一般针对以下情况应当重新确认: |
|
|
清洗过程 |
安装确认 |
1)清洗过程的环境应当符合要求。 |
|
运行确认 |
1)设备可以按照预定设计的参数运行。 |
|
|
性能确认 |
1)应当使用按照正常工艺下生产的产品作性能确认。应当通过预期使用的清洗过程。 |
|
|
再确认 |
1)经过一定周期。 |
|
|
封口过程 |
安装确认 |
1)安装条件,如工作电源等;设备在标称的设计参数下可正常运行,如加热温度、冷却温度、封口速度、压力、预热时间等; |
|
运行确认 |
1)一般应根据具体的无菌包装材料和封口设备,识别关键过程参数并确定各过程参数的特性曲线,如加热温度、冷却温度、压力、封口速度、预热时间等;建议利用高一级精度的设备对以上参数的特性曲线进行确认; |
|
|
性能确认 |
1)应使用带有实际产品或模拟替代物的医疗器械包装; |
|
|
回顾性验证 |
适当时,可以进行回顾性验证。对于已使用的无菌包装封口过程,过程确认也可以利用产品试验数据、生产过程记录、产品检验记录等历史数据。这些数据应完整,且一般应: |
|
|
再确认 |
1)生产一定周期后; |
|
|
工艺用水 |
安装确认 |
1)工艺用水系统所处的环境是清洁的。 |
|
运行确认 |
1)工艺用水系统试运行,确定预处理系统、脱盐装置、后处理装置、贮存装置、控制系统和仪器仪表能够按照预定的设计参数及上下极限参数正常运行,并能生产出符合标准要求的工艺用水。 |
|
|
性能确认 |
1)本部分验证是为了保障工艺用水系统的稳定性和可靠性,一般分为三个阶段。 |
|
|
再确认 |
1)生产一定周期后。应每年对工艺用水系统进行再确认,或可采取对历史数据的回顾和总结的方式对水系统进行再确认。 |
参考文献:
1、医疗器械生产质量管理规范
2、ISO13485:2016医疗器械 质量管理体系 用于法规的要求
3、医疗器械GMP现场检查指导原则
4、无菌医疗器械现场检查指导原则.
5、医疗器械工艺用水质量管理指南
6、医疗器械工艺用水系统确认检查要点指南(北京局)
7、医疗器械产品清洗过程确认检查要点指南(北京局)
8、医疗器械无菌试验检查要点指南(北京局)
9、医疗器械灭菌工艺检查要点指南(北京局)
10、医疗器械工艺用气检查要点指南(北京局)
11、无菌包装封口过程确认检查要点指南(北京局)
12、FDA21CFR820质量体系法规

来源:医疗人咖啡


