您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-25 20:20
杂质研究是药品质量一致性评价的重点内容,关系到药品的安全性、有效性和质量可控性。本文结合具体品种,汇总分析了杂质研究的常见问题及关注点,并提出相应的处理建议,旨在为后续口服固体制剂和注射剂仿制药一致性评价的研究提供更多参考。
杂质是药品的关键质量属性,可能影响药品的安全性和有效性。杂质研究是体外药学研究的主要内容,贯穿于药品的研发、生产及上市后变更等整个生命周期。口服固体制剂和注射剂仿制药质量和疗效一致性评价的相关技术要求[1—4],均强调杂质研究是质量一致性评价的重点内容,要求进行多批次自制品与参比制剂的杂质谱对比研究,保证自制品与参比制剂的杂质水平一致。新4 类口服固体制剂和注射剂仿制药的技术要求与一致性评价品种相同。化学药品的杂质研究实际上已经有非常成熟的指导原则,如新原料药和新制剂中的杂质应分别参照新原料药中的杂质研究指导原则[ 人用药品注册技术要求国际协调会( ICH)Q3A]、新制剂中的杂质研究指导原则( ICH Q3B) 进行研究[5—6] ;化学药品( 包括新药、仿制药) 均需参照《中华人民共和国药典》(ChP)2020 年版四部通则“9102 药品杂质分析指导原则”进行研究。
但是在审评中发现,除了杂质研究不充分外,还有其他一些问题,比如在杂质研究时忽略产品特性,研究的杂质不是潜在风险较高的杂质;与新技术要求脱节,研究方法落后,控制策略欠合理;杂质过度研究,使研发难度和投入增大、药品上市延迟。我们并不提倡杂质过度研究,建议结合产品特点,以参比制剂信息为基础,参照相关技术指导原则及国内外药典收载情况,对杂质进行科学合理的研究及控制。本文结合审评案例,对化学药品的杂质研究中常见的问题进行分析,提出相应的处理建议,为后续口服固体制剂和注射剂仿制药质量和疗效一致性评价提供参考。
1 杂质分析的基本原则
制剂中杂质来源主要有原料药引入、制剂制备和贮存过程引入或降解产生等。在原料药的杂质研究和控制符合要求的基础上,制剂中主要对降解杂质进行研究,一般不需要再重复研究和控制原料药的工艺杂质。杂质谱分析应结合原料药的降解途径、原料药与辅料及内包材的相容性研究结果等,对产品中潜在的一般有机杂质、异构体、基因毒性杂质、残留溶剂和元素杂质等进行详细分析,说明杂质的来源、检出结果、控制策略及拟定依据等。杂质研究可参照ICH 各项指导原则进行。但是ICH 指导原则主要针对新药,因此研究仿制药时,还应该结合仿制药的特性进行,围绕参比制剂的情况,如参比制剂的质量研究信息或药典等法定标准等,进行全面的杂质分析和对比研究,并在此基础上建立经规范验证可行的分析方法,拟定合理的限度。
2 杂质分析及控制策略
2.1 一般有机杂质
杂质的种类较多,一般有机杂质区别于基因毒性杂质、异构体、残留溶剂等,通常在质量标准中体现在有关物质项下。一般有机杂质的研究中通常只重点关注原料药降解产生的杂质,而忽略了其他途径引入的杂质,如制剂中的辅料、制备过程中使用的溶剂等与原料药反应产生的工艺杂质或降解杂质。如琥珀酸普芦卡必利片中若使用辅料乳糖,乳糖的羟基与琥珀酸普芦卡必利结构中的氨基易发生取代反应,生成乳糖加合物杂质;稳定性研究表明水分会显著加速该杂质的降解产生。对于使用了乳糖的处方,应进行该杂质的研究和控制,并考察稳定性试验期间该杂质是否符合限度要求。
同样,制剂中若使用了溶剂,除了考察溶剂残留外,还应研究溶剂是否会与原料药反应而产生杂质。如瑞舒伐他汀钙片,在制备过程中若使用了乙醇等黏合剂,在制粒、干燥过程中高湿、高温等因素的作用下,乙醇与瑞舒伐他汀酸反应可能生成乙酯杂质,美国药典(USP)43 版中瑞舒伐他汀钙片标准规定,若存在乙酯杂质,则其限度不得超过0.5%。因此进行制剂杂质研究时除了降解杂质外,还应关注原料药与辅料、溶剂等在制备和存放过程中反应而产生的杂质。根据影响因素、稳定性试验等考察结果确定是否为降解杂质及加速降解的条件,并与参比制剂进行杂质含量的比较,原则上该杂质含量不得大于参比制剂的限度标准。
若该杂质为自制品特有的杂质,且稳定性考察期间超过了鉴定限,则提示处方工艺或包装材料等不合理,推荐首先进行相应的筛选和优化,降低杂质含量;若仍无法使杂质含量降低至鉴定限以下,则应进行结构确证及相关的毒理学研究,并评估确定拟定限度下的杂质不会对药品的安全性和有效性产生影响。
2.2 异构体杂质
2.2.1 降解产生的异构体杂质
通常来讲,异构体被认为是工艺杂质,在制剂杂质研究中易被忽略。实际上异构体杂质也是有机杂质的一种,研究思路、控制策略与有机杂质相似,依据来源也分为工艺杂质和降解杂质。部分药品的异构体为降解杂质,如硫酸氢氯吡格雷,其结构中酯键的α- 位碳易受酸、碱条件的影响发生构型转化,产生对映异构体杂质,故ChP 和USP 中均控制了对映异构体杂质。除非有可靠的文献或原研专利等资料证明异构体杂质为工艺杂质,否则均应在制剂中进行研究,根据研究结果确定为非降解杂质时,可不订入质量标准。
2.2.2 多手性中心药物的异构体杂质
多手性中心药物的异构体杂质较多,且非对映异构体杂质产生的概率比对映异构体更大,除监测对映异构体外,还应研究和监测非对映异构体。如替格瑞洛结构中有6 个不对称手性中心,包括替格瑞洛在内,共可能产生64 个异构体,在终产品质量标准中建立合适的分析方法控制所有的异构体杂质难度极大,也不符合源头控制和过程控制的理念。对于该类药物的异构体杂质分析,通常采用分阶段控制策略,首先结合合成路线及反应机制分析异构体杂质的来源,明确是来自起始原料、合成过程还是存放过程,再结合各个阶段产生异构体杂质的风险及分析方法建立的难易程度等因素,拟定科学合理的控制策略。同时应注意,对于同为工艺杂质和降解杂质的异构体,仅在起始物料或中间体中控制并不能保证产品的光学纯度,还应在制剂中进行异构体杂质研究。比如,替格瑞洛的三元环上7,9- 位手性碳构型不同的异构体杂质,除了由起始物料引入外,还可能由光照下2位的手性碳构型翻转产生,因此在制剂中应进行这类异构体杂质的研究和控制[7]。
2.3 基因毒性杂质
自ICH M7《评估和控制药物中的DNA活性( 致突变) 杂质以限制潜在的致癌风险》实施以来[8],原料药及制剂的上市申请应参照该指导原则进行基因毒性杂质研究。2018 年7 月发现已上市的缬沙坦原料药中存在亚硝胺类杂质超标的事件,引起公众对药品安全性的关注。各国药品监管机构对亚硝胺类杂质的研究不断深入,警示信息及指导原则频繁推出。2020 年5 月8 日,国家药品监督管理局药品审评中心发布《化学药物中亚硝胺类杂质研究技术指导原则( 试行)》[9]。随着对基因毒性杂质研究关注度的不断提高,相关技术要求也不断提升,要结合原料药因素和制剂因素等综合分析确定待研究的基因毒性杂质及来源,参照ICH M7 及毒理学研究数据等拟定合理的限度,建立灵敏度和准确度等验证可行的分析方法,根据研究结果拟定科学合理的控制策略。
2.3.1 原料药中引入的基因毒性杂质
原料药中引入的基因毒性杂质一直是研究的重点,尤其对具有较高致癌性( 即“关注队列”) 的物质,应保持更高的警惕性和敏感度。如缬沙坦原料药中存在的亚硝胺类杂质主要包括N- 亚硝基二甲胺(NDMA) 和N- 亚硝基二乙胺(NDEA) 等,均属于2A 类致癌物质,是ICH M7 指南中明确指出的“关注队列”物质,应在药品中予以严格控制。该类基因毒性杂质应采用“避免为主、控制为辅”的控制策略,从原料药的工艺路线、物料污染、降解产生等方面评估引入亚硝胺类杂质的风险,尽量避免选择可能生成该类杂质的生产工艺。若必须使用时,则须根据工艺路线分析可能生成的亚硝胺类杂质的结构,并优化工艺如筛选精制溶剂、增加杂质清除步骤等提高对该类杂质的清除能力,建立经验证可行的分析方法用于过程监测和控制,保证生产过程中此类杂质的有效去除。
除沙坦类药物外,其他药物的制备中只要同时使用了胺类化合物与亚硝酸盐,也应研究可能生成的相关亚硝胺类杂质。如替格瑞洛工艺路线( 图1)的步骤2 在亚硝酸钠/ 乙酸条件下进行重氮化环化反应[10],理论上可能与胺类化合物如中间体M1 中含有的二级胺结构,或胺类试剂如三乙醇胺(TEA)、三乙胺等引入的二级胺试剂等相互作用,存在产生相应亚硝胺类杂质的风险,应参照相关指导原则进行风险评估和研究。
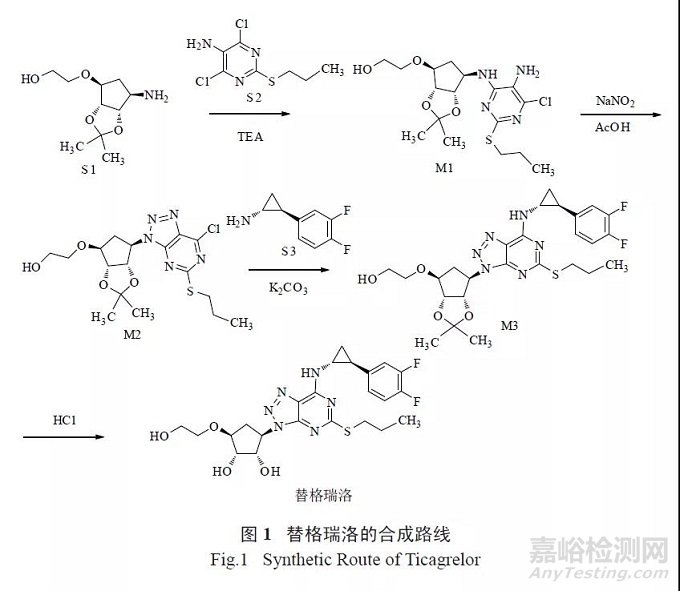
亚硝胺类杂质的限度极低,每日1.5 μg 的限度要求不足以充分控制风险,对于各药品监管机构已公布限度要求的亚硝胺类杂质,拟定限度应不得高于公布限度;此外应参照ICH M7 指南的相关规定,根据此类杂质的安全性数据、制剂的用法用量等情况综合确定合理的限度。
2.3.2 降解产生的基因毒性杂质
基因毒性杂质也可能是降解杂质,所以也要关注制剂在制备和贮存过程中产生的降解杂质。如制备甲磺酸达比加群酯胶囊时通常使用乙醇或异丙醇配制包衣液,醇类溶剂易与甲磺酸反应生成具有基因毒性的甲磺酸酯类杂质,制剂中应注意控制,并确保稳定性考察期间该类杂质限度符合ICH M7 要求。另外,雷尼替丁制剂在存放过程中,尤其是在高于室温的环境下存放,随着时间延长,NDMA 的含量可能逐渐增长至超过人体可接受水平。
2020 年4 月,美国FDA 要求药品生产商从市场上撤回所有雷尼替丁的相关制剂。ChP 委员会对雷尼替丁相关的药品标准也进行了修订,要求企业对生产工艺进行评估以确定形成NDMA 等杂质的可能性。必要时,应采用适宜方法分析产品,确认NDMA 等杂质的含量符合我国药品监管部门相关指导原则或ICH M7 指导原则的要求[11]。
由此可见,随着科学技术的发展,对具有致癌、致突变性基因毒性杂质的研究越发深入,将会出现新的基因毒性杂质结构,已有基因毒性杂质的控制限度和方法也会随之调整。因此在整个产品生命周期中均应关注基因毒性杂质的研究进展,与时俱进地开展研究,制定合理的控制策略。
2.4 残留溶剂
在制剂制备时,溶剂一般用作黏合剂或配制包衣液,也应作为杂质谱的一部分进行分析研究。若能使用纯化水替代,一般就不推荐使用溶剂,因为在制粒、干燥和包衣的高湿、高温环境下,溶剂与主药或辅料接触可能会引入杂质,甚至是基因毒性杂质。应注意不推荐使用Ⅱ类溶剂,除非有充分的依据支持必须使用的合理性。如果使用,应进行溶剂残留及相关反应产物的评估和研究。
2.5 元素杂质
元素杂质研究主要参照ICH Q3D《元素杂质指导原则》[12]。中国作为ICH 成员国,也在逐步推进ICH Q3D 的实施。《化学药品注射剂仿制药质量和疗效一致性评价技术要求》明确提出应进行元素杂质的研究。根据不同给药途径的药品中元素杂质的风险评估,口服固体制剂元素杂质的风险远低于注射剂,口服固体仿制药一致性评价时尚未要求研究元素杂质。但是,对部分存在高风险元素杂质的口服固体制剂也应参照指导原则进行研究。如原料药合成反应中有意加入含有元素杂质的催化剂;来源于矿物或稀土的原料药中含有多种天然存在的元素杂质,如碳酸镧;部分特殊辅料中也可能引入元素杂质等。
3 分析方法的建立和验证
有关物质分析方法的开发,应以充分的杂质分析作基础。一般要求参照已有的标准如药典标准、原研品检测方法等,结合自制品的杂质种类、极性强弱等优化色谱条件,满足方法系统适用性的要求。若自建方法与已有标准差异较大,一般要求提供2种方法的系统适用性、检测灵敏度、多批自制品和参比制剂检测结果的对比研究数据,说明自建方法的检测能力不低于已有标准方法。
杂质种类的增加要求更好的适用性,限度的降低要求更高的灵敏度,方法学验证应证明自建方法可满足杂质检测的适用性、灵敏度、准确度等要求。方法学验证已有明确的指导原则,以下主要介绍几个关注点。
系统适用性要求拟定时,应关注不易分离的主峰与杂质峰、相邻的2 个及以上杂质峰,这些色谱峰之间的分离度受到色谱条件波动的影响很可能不符合要求,应将这些色谱峰之间的分离度要求制定入系统适用性标准。系统适用性应反映实际样品检测时的分离度情况,主成分浓度应与供试品溶液一致,已知杂质的浓度应不低于限度浓度。对于灵敏度较低的分析方法,为保证每次样品检测时的灵敏度均能满足要求,建议系统适用性中增加灵敏度溶液和要求。
选择有关物质检测波长时应兼顾主成分和大多数已知杂质的最大吸收波长;个别与主成分紫外吸收差异较大的杂质,应根据校正因子的测定结果选择用外标法或加校正因子的主成分自身对照法计算。校正因子测定的前提是获得含量准确的已知杂质对照品,同时应进行全面的校正因子验证,否则会影响测得校正因子的准确性,进而影响杂质检测结果。
人体可接受的基因毒性杂质的限度很低,对分析方法的灵敏度、准确度等有更高的要求;且部分基因毒性杂质性质活泼、稳定性差,痕量分析极具挑战性[13]。建立分析方法时可参照国内外药品监管机构、药典等公布的方法,结合自制品的特点建立合适的分析方法,并进行全面的方法学验证。制剂中基因毒性杂质检测时的辅料因素以及供试品溶液配制方法,如提取溶剂种类和用量、超声时间、离心转速和时间、滤膜材质和孔径等,均可能影响提取回收率,应进行考察,必要时应将相关规定制定入质量标准。
质量标准控制多个已知杂质时,推荐采用准确度高的杂质对照品定位法,并将典型的系统适用性图谱作为质量标准的附件,以便准确定位已知杂质;若采用相对保留时间定位,色谱柱的品牌、型号,流动相比例,柱温等色谱条件的微小变化均可能影响杂质的相对保留时间,尤其对相邻且限度差异大的杂质,定位错误就会影响对产品质量合格与否的判断,故要进行相对保留时间的耐用性考察,必要时改用杂质对照品定位法或者将影响较大的色谱条件固定并制定入质量标准。
对于部分稳定性较差的药物,还应根据溶液稳定性研究结果评估是否需要在标准中增加“避光操作”和“临用现制”等特殊操作要求。
4 结论
仿制药的杂质研究应坚持2 个基本原则,以药品的特点为基础,以参比制剂为参照,否则很容易出现杂质研究不全面或过度研究的问题。杂质是药品的关键质量属性,充分的杂质研究是拟定科学合理的质量标准的基础,更是药品的安全性、有效性、质量可控性的重要保障。同时,杂质研究也是一个发展的过程,需要随着技术的进步、监管要求的提升,及时开展研究,建立一个完善合理的质量保证体系以保证产品在批准后的整个产品生命周期达到与参比制剂质量的一致。
作者|赵 娜,石 靖*(CDE)
内容来源|中国医药工业杂志 2021.05

来源:Internet


