您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2021-09-02 20:16
内容提要: 冠脉支架植入是临床治疗冠心病患者的重要手段之一。本文阐述不同类型冠脉介入支架的表介质特点及植入后冠脉再狭窄机制,旨在为新型冠脉支架的研发提供理论支持。
随着人类生活起居习惯和饮食结构的变化,以及老龄化社会的逐步形成,目前心血管疾病的发病率和死亡率稳居各种疾病的首位。据2015 年中国心脏病报告,由于冠心病冠脉狭窄引起的心衰占70%~90%,已经成为危及人类生命健康安全的主要疾病之一[1]。
冠状动脉支架(coronary stent),是通过传统的球囊扩张导管,把支架植入血管狭窄区,是心脏介入手术中常用的医疗器械,具有疏通动脉血管的作用。冠脉介入支架治疗方法因其创伤小、效果好,成为目前治疗心血管狭窄的主要手段之一。1984 年,中国开展了第一例心脏金属裸支架介入手术,开拓了冠心病特别是心肌梗死治疗的全新局面。随着科学技术的飞速发展,支架技术也日新月异,但同时也存在诸多问题。本文聚焦于各型冠脉介入支架的特点及预防再狭窄的技术研究进展。
1.各型冠脉支架特点
1.1 裸支架(Bare Stent):Dr.Dotter[2] 在1964 年首先提出可利用支架来预防冠脉狭窄的设想,并于1969 年成功研发出首例裸金属弹簧支架。1982 年,Maass 等研发出一种双螺旋、可自行扩张的支架,为人们开启了思路。自此,掀起了冠脉支架的研究浪潮,此后相继出现了缠绕型支架、管状支架、模块状支架及网状支架(图1)。20 世纪80 年代,美国Sigward 等[3] 用Medivent Wallstent 实施了第一例冠脉支架手术,但随着临床长期观察,发现金属裸支架比较容易引发血栓,再狭窄率较高。根据材料,支架又分为不锈钢、镍钛合金或钴铬合金支架。其带正电荷的金属离子直接接触血液成分,很容易激活凝血系统和血小板,导致急性血栓形成,支架植入后再狭窄率高达30%~40%[4,5]。裸支架目前已被淘汰,或者仅用来制作各种涂层支架和药物支架的载体。
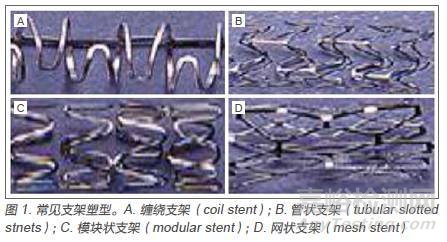
1.2 生物涂层支架和药物涂层支架
为避免带正电荷的金属离子直接与血液成分接触, 人们想到在金属支架表面镀上一层膜,试图在支架与血管之间筑起一道屏障。比较常见的是生物涂层支架(Bioactivator Eluting Stent,BES)和药物涂层支架(Drug Eluting Stent,DES)。
生物涂层支架分为:①多聚物涂层支架:可避免带正电荷的金属离子直接接触血液成分,具有较好的弹性,对血管损伤较金属更小。降低凝血系统和血小板激活,减少急性血栓形成。但单纯使用聚酯被覆支架试验结果并不十分理想,目前这种支架更多的是作为抗血栓、抗增殖药物的载体[6]。②纤维蛋白被覆金属支架:纤维蛋白在体外试验中有促进周围血管移植的内皮化进程和手术中止血的作用。使局部血管结构保持完整,减少再狭窄的发生率。纤维蛋白具有极强的水溶性,又具有生物降解性,可作为局部给药载体。③磷酰基胆碱涂层支架:磷酰基胆碱为生物膜外层的成分,是由亲水性和疏水性基团构成的异分子聚合物并有水凝胶的性质。可减少蛋白粘附、血栓形成和不良组织反应,从而在细胞生物相容性方面发挥重大作用。生物涂层支架是目前临床常用的支架,适用于大多数者。
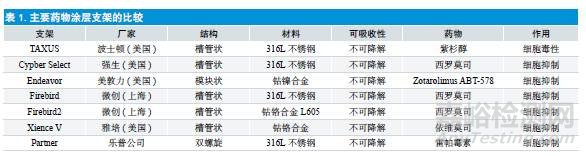
药物涂层支架:虽然生物涂层支架能够起到一定的预防再狭窄的作用,但支架作为异物可刺激局部组织出现一些炎症和免疫反应,这是单纯隔离无法解决的实际问题。于是科研工作者经过不懈努力,终于将药物和支架结合在一起,创造了第二代冠脉支架(DES),即在金属支架表面“镀上”一层药膜。这种支架植入体内后,药物便会缓慢释放出来,抑制疤痕组织在支架周围生长,保持冠状动脉通畅。2002 年强生Cypher药物支架上市,从此介入支架进入新时代。目前临床常用的药物涂层支架包括雷帕霉素涂层(Rapamycine elutingg stent,RES)和紫杉醇涂层支架(PTX eluting stent,PES)。
雷帕霉素为天然的大环内酯类抗生素,具有很强的免疫抑制作用和抗炎作用。血管内膜受损后,雷帕霉素可与血管平滑肌细胞上表达上调的FK506 结合蛋白(FKBP12)结合,结合后所形成的复合物具有强烈抑制平滑肌细胞增殖和迁移的作用;此外,雷帕霉素FKBP12 复合物可增强P27 活性,使细胞周期停滞于G1-S 阶段[7]。用于DES 的雷帕霉素的类似物及衍生药物还包括[8]:①西罗莫司(Sirolimus)洗脱支架(SES):Cypher、Cypher Select、Firebird、Firebird2、Partner ;②依维莫司(everolimus)洗脱支架(EES):XIENCE V,PROMUS Element ;③左他莫司(Zotarolimus)洗脱支架(ZES):Endeavor,Endeavor Resolute 等。
紫杉醇是一种衍生的二萜类化合物,能特异性地与细胞中β -微管蛋白结合,促进α、β -微管蛋白聚合,拮抗β -微管蛋白解聚,稳定微管结构,而微管的解聚是细胞有丝分裂所必需的,因此,紫杉醇可有效地阻止细胞的分裂、增殖。同时,紫杉醇还能抑制血小板源性生长因子对血管平滑肌细胞的刺激,抑制由此产生的平滑肌细胞的增殖和迁移;而且,紫杉醇抑制新生内膜的效能呈明显的剂量依赖性[9,10]。现有PES 包括:TAXUS Express,TAXUS Liberte,TAXUS Element 和垠艺支架等。
肝素涂层支架:肝素涂层支架能够使肝素缓慢释放并保持其生物活性,在支架周围有效、持久、稳定地发挥抗凝血作用。其他类似抗凝血药物涂层支架,如水蛭素、血小板GP Ⅱ b/ Ⅲ a 的受体拮抗剂(AZI)、以腺病毒为载体携带尿激酶前体(Pro UK)基因均处于研发阶段。这类支架提高了局部给药浓度,解决了抗凝治疗的高费用和并发症问题。
1.3 完全可降解支架
鉴于镀膜支架上的药物终会耗尽,支架长期存留易形成血栓、妨碍血管弹性及血管改建。研究表明,血管闭塞和再狭窄主要发生在最初的6个月中,因而21 世纪初,有人研究用生物可降解物质制作血管内支架,以便在一定时间内支撑管腔,保持血管通畅,当急性期过去后它可以逐渐降解乃至消失,从而避免了局部炎症反应的不良后果,有效防治血管扩张后的急性闭塞和再狭窄[11,12]。2011 年Abbott 可降解支架BVS 拿到CE证书标志着心脏介入治疗进入新阶段。
可降解支架主要包括金属可降解支架(镁合金支架和铁基支架)和全降解聚合物支架(聚乳酸类降解支架)。它们通过两种水解方式降解[11],其一是大块降解,侵蚀遍布整个聚合物,这是亲水性或非晶体结构聚合物的主要降解方式;其二是表面降解,侵蚀仅发生于聚合物表面,聚合物的机械强度逐渐下降,不易断裂破碎,这是疏水性或晶体结构聚合物的主要降解方式。
金属可吸收支架特点:机械性能好,显影性好,降解速度不易控制,金属离子在体内副作用有待于研究。
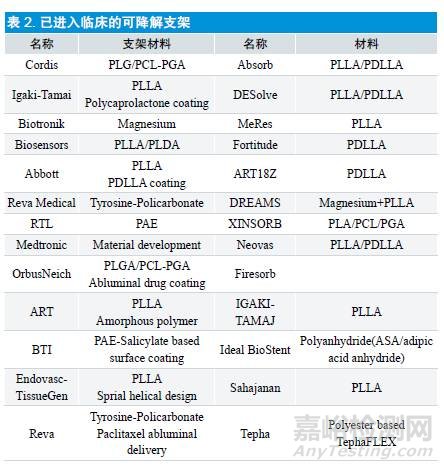
全降解聚合物支架:聚合物支架完全由生物可降解的物质化学聚合而成,这一类物质很多,主要是聚酯类,包括聚乳酸(PLA)、聚乳酸多聚物(PLLA)、聚羟基乙酸(PGLA)、聚羟基乙酸/ 聚乳酸共聚物(PELA)、聚已酸丙酯(PCL)、聚羟基丁酸戊酯(PHBV)、聚正酯(POE)和聚氧化乙烯/ 聚丁烯共聚物(PEO/PBTP)等。
聚合物支架往往载有药物,加载的药物可以通过扩散机制或随着聚合物的降解而释放,其释放主要有三种方式[11,13] :①药物混合于聚合物中,以弥散方式释放,待其排空后聚合物才开始降解;② 334 药物非共价结合于聚合物中,聚合物表面发生水解,交链撕裂,释放药物;③药物与聚合物间为共价结合,只有当可降解支架的出现使得药物的局部共价键断裂,药物才开始释放,持续时间较前两种长。
生物可降解物质仅引起轻微的异物反应,在损伤修复过程中炎症反应轻微,无热原、无溶血、无全身毒性和细胞毒性,有良好的生物相容性和可吸收性。整个过程较少引起新生内膜增生及血栓形成,能在一定的时间内保持血管的通畅性,在完成机械性支撑作用后降解成无毒的产物,通过呼吸系统和泌尿系统完全排出体外。支架吸收后,血管壁能维持正常的功能。但生物可降解性支架在机械强度、体积及所载药物的释放速度等方面还不能完全适应临床需要,有待进一步研究解决。
2.支架内再狭窄
目前临床上支架植入后主要问题是支架内再狭窄(In-stent Restenosis)[14],支架内狭窄的治疗难度较大,一般只能进行心外手术,大大增加了治疗费用和危险性。裸支架再狭窄率高达20%~30% ;药物洗脱支架再狭窄到10% 以下,晚期血栓的发生率仅有1%~2%,但由于裸支架依然作为异物长期存在,还是会引发晚期血栓和极晚期不良事件,致死率45% ;全降解支架完成支撑血管恢复血流的使命后,在再狭窄发生之前完全降解。
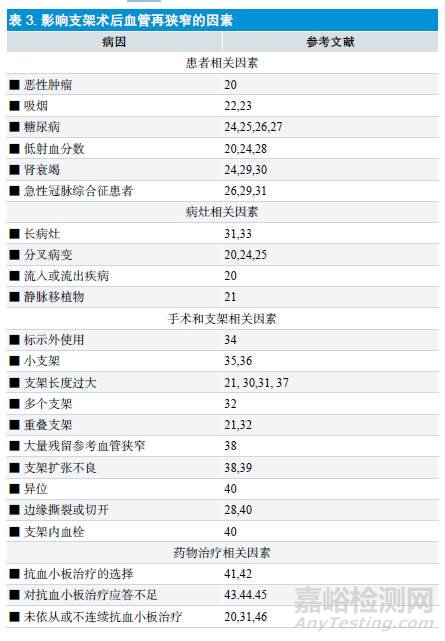
支架植入后再狭窄机制与冠心病狭窄机制不同[15~17],主要包括两方面:①球囊和支架膨胀机械刺激作用造成的内皮受损后血管平滑肌细胞的反应性增殖和内膜增生,引起异物样体液和细胞炎性反应,一旦内膜增生超过支架扩张给予血管腔的补偿,再狭窄不可避免。②金属表面正离子及不同亲疏水特性的表介质材料与血液成分接触,会吸附血液中的蛋白质(如γ- 球蛋白或纤维蛋白原),当所吸附的蛋白质达到一定厚度时,可引起血液细胞成分粘附,如血小板和红细胞。当血小板直接被吸附后,形状会变成扁平,继而被激活、凝集。当红细胞被吸附后,破裂并释放出红细胞素和二磷酸腺苷等促凝血因子,从而引起血小板粘附、变形、凝集,进而导致凝血的发生。除了上述机制外,材料表面吸附的蛋白质会引起血液中内源性和外源性凝固系统的激活,从而发生一系列的生化反应而导致血栓形成。
针对再狭窄发生的可能机制,许多学者对新型支架进行了多方面的研究,主要集中于支架的力学相容性和组织相容性两个方面[18,19]。前者主要研究采用新材料和改善支架的几何设计;后者重点在于改善支架的表面血栓源性,从而减少血栓发生。将表面涂覆技术应用于支架表面。但在临床,冠脉支架植入后再狭窄,除了要考虑支架自身因素外,还要考虑其他与血栓生成相关的因素[20,21]。
3.展望
理想的支架应具备灵活、示踪性好、不透X光、抗血栓、生物相容性好、扩张性能可靠、支撑力好、覆盖好、表面积小、符合流体力学等特征。每种支架都有各自的特性,熟悉各种支架的特性是保证介入治疗成功的前提。至今市场上还不存在具备上述全部特征的支架,人们还在不断积极探索优化的新方法。
临床应用的各类冠脉支架较多,每种支架都有自己的特点。裸支架目前已被淘汰,或者仅用来制作各种涂层支架和药物支架的载体。药物支架费用太高,植入药物支架后冠脉内膜延期愈合(其愈合期长达达1 年),每天必须服用抗血小板制剂。目前比较经济实惠的还属于药物涂层支架,适合大多数患者。
支架表介质电荷(静电电位)、与水的亲合力、表面能、表面的形态结构以及表面化学性质是支架植入手术预后的决定因素。目前支架表面介质的修饰方法包括生物方法、化学方法以及物理低温等离子体以低气压放电产生的电离气体,其中蕴含着丰富的活性粒子,可对材料表面进行镀膜、聚合、修饰和改性,对材料进行表面修饰是减少血栓形成,提高血管内支架血液相容性最有效的方法。新近出现了组织工程方法,其原理是从机体获得少量的自体组织,将种子细胞从中分离出来并在体外进行扩增,然后将扩增的细胞粘附到支架上,形成细胞——材料复合物[47,48]。将该复合物植入机体的组织或器官病损部位,随着生物材料在体内的降解和吸收,植入的细胞在体内不断增长和分泌外基质而最终形成相应的组织,达到修复创伤和重建功能的目的,这是一种较有应用前景的方法。
参考文献
略

来源:《中国医疗器械信息》


