您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-09 19:53
摘要 目的:系统评价呼吸系统吸入制剂的研发现状。方法:在5 个文献数据库(PubMed、Embase、中国知网、万方数据和维普网)和4 个临床试验注册平台、15 个国家/地区药品监督管理平台及药智网中检索有关国内外呼吸系统吸入制剂研发现状的相关文献或数据,采用描述性方法分析其研究现状。结果与结论:共纳入二次研究文献27 篇,并收集到欧盟、美国、加拿大、日本以及我国批准上市的呼吸系统吸入制剂信息和我国正在注册审批中的相关药品信息。呼吸系统吸入制剂的市场情况方面:从剂型角度分析,全球各剂型按销售金额统计,粉雾剂占46%,气雾剂占32%,雾化吸入溶液占22%;从市场份额角度分析,英国AstraZeneca、德国Boehringer Ingelheim 和英国GlaxoSmithKline 等公司的市场份额合计约70%。目前,呼吸系统吸入制剂在欧盟上市了39 种,美国上市了121 种,加拿大上市了111 种,日本上市了37 种,我国上市了国产吸入制剂69 种、进口吸入制剂80 种。呼吸系统吸入制剂正在进行的临床试验国外有511 项,国内有69 项。呼吸系统吸入制剂仿制障碍主要包括研发、临床试验、审批和生产障碍等。目前,我国通过一系列政策对国产药品创新和医疗器械国产化提供支持,将有助于促进吸入制剂的国产化研发。未来研发可更多关注吸入制剂药物联用、适应证、剂型、装置等方面。
正 文
全球疾病负担(global burden of disease,GBD)的调查数据显示,呼吸系统疾病是全球主要的死亡和残疾原因之一;在前30 种常见死因中,呼吸系统疾病共占5 位,包括慢性阻塞性肺疾病(COPD,第3 位)、下呼吸道感染(第4 位)、支气管-肺癌(第6 位)、结核病(第12 位)、哮喘(第28 位)[1]。国际呼吸学会论坛的报道显示,全球约6 500 万人罹患COPD,每年约300 万人死于COPD,该病已成为全球第三大死因[2]。《中国居民营养与慢性病状况报告(2015 年)》显示,慢性病死亡人数占总死亡人数的86.6%,其中慢性呼吸系统疾病的死亡人数占慢性病死亡人数的12.8%,已成为我国居民第三大慢性病死因,仅次于心脑血管疾病和癌症[3]。2019 年,中国肺部健康研究组发表在《柳叶刀》上的调查显示,截止2015 年我国哮喘患者人数已超过4 000 万人,但仅有28.8%的患者得到诊断,在确诊人群中也仅有10.2%的患者接受了规范治疗[4]。据估计,目前我国COPD患者接近1 亿人,经肺功能检查确诊的患者中仅有2.6%知晓自身疾病[5]。可见,患者基数庞大、诊治率低的呼吸系统疾病已成为当前我国面临的较为严峻的公共卫生问题之一。
目前,呼吸系统疾病用药主要为吸入制剂,剂型以气雾剂和粉雾剂为主[6]。呼吸系统吸入制剂根据药物活性可分为:糖皮质激素、β2受体激动剂、抗胆碱药、抗炎药、祛痰药、抗微生物药、气道消泡剂、前列环素类似物[7]。目前,国内医院吸入制剂市场份额以进口原研药为主,国内的吸入制剂市场几乎被英国AstraZeneca (AZ)公司、德国Boehringer Ingelheim(BI)公司和英国GlaxoSmithKline(GSK)公司等呼吸系统药物巨头企业垄断[8]。随着国内吸入制剂市场的不断发展和国家陆续推出的扶持政策,国内研发和生产吸入制剂的药企正不断崛起。为了解全球吸入制剂的研发现状,本研究拟采用系统评价法对其进行描述性分析,旨在为吸入制剂的研发提供参考。
1、资料与方法
1.1 基于二次研究证据的系统评价方法
1.1.1 纳入标准
本研究的纳入标准包括:描述国内外呼吸系统吸入制剂研发现状(包括呼吸系统吸入制剂市场情况、仿制障碍、研发相关指南和政策、上市药品情况、正在研发的药品情况、临床试验设计与评价相关指南和政策)的系统评价、综述、报告。
1.1.2 排除标准
本研究的排除标准包括:重复发表的文献;非中、英文文献;无法获取原文的文献。
1.1.3 文献检索策略
计算机检索PubMed、Embase、中国知网、万方数据、维普网等5个文献数据库,检索时限为2015年1月1日-2020年8月4日,并通过百度、必应等搜索引擎进行补充检索。英文检索词包括“inhalation”“aerosol”“dry powder”“soft mist”“atomization”“research progress”“research status”“development status”“review”等,中文检索词包括“吸入”“气雾”“干粉”“软雾”“雾化”“研发现状”“研究进展”“上市”“注册”等。采用主题词与自由词结合的方式进行检索。
1.1.4 资料筛选与提取
由两名研究者独立筛选文献及提取资料,并交叉核对;若有争议,由第三人裁定。提取信息包括:国内外呼吸系统吸入制剂的市场情况、仿制障碍、研发相关指南和政策、上市药品情况、正在研发的药品情况、临床试验设计与评价相关指南和政策等。
1.1.5 资料分析方法
采用描述性分析方法,描述呼吸系统吸入制剂的研发现状。
1.2 基于原始研究证据的系统评价方法
1.2.1 纳入标准
根据系统评价的PICOS原则筛选文献。其中,研究对象(P)不限;干预措施(I)为呼吸系统吸入制剂,包括糖皮质激素(布地奈德、丙酸氟替卡松、丙酸倍氯米松等)、β2受体激动剂(沙丁胺醇、特布他林、福莫特罗等)、β2受体激动剂与糖皮质激素的复方制剂(沙美特罗替卡松、布地奈德福莫特罗、倍氯米松福莫特罗等)、M胆碱受体拮抗剂(异丙托溴铵、噻托溴铵等)、M胆碱受体拮抗剂与β2受体激动剂的复方制剂(乌美溴铵-三苯乙酸维兰特罗)等;对照措施(C)、结局(O)及研究设计方案(S)均不限。
1.2.2 排除标准
本研究的排除标准包括:重复发表的文献;非中、英文文献;无法获取原文的文献。
1.2.3 文献检索策略
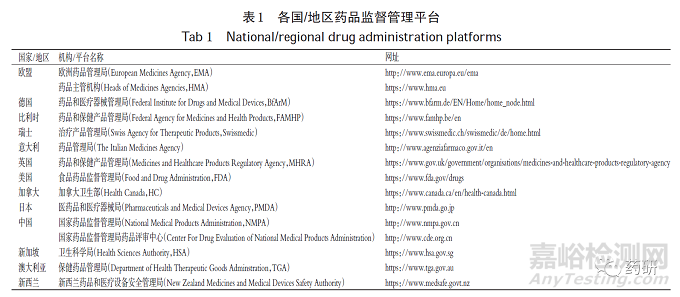
检索数据库包括可用英语检索的各个国家/地区药品监督管理平台(表1)、临床试验注册平台(包括世界卫生组织临床试验数据库、Cochrane 临床试验数据库、美国临床试验数据库、中国药物临床试验登记与信息公示平台)以及药智网等。检索时限均为建库至2020 年8 月4 日。英文检索词包括“inhalation”“aerosol”“dry powder”“soft mist”“atomization”等;中文检索词包括“吸入”“气雾”“干粉”“软雾”“雾化”“糖皮质激素”“布地奈德”“丙酸氟替卡松”“丙酸倍氯米松”“β2受体激动剂”“沙丁胺醇”“特布他林”“福莫特罗等”“沙美特罗替卡松”“布地奈德福莫特罗”“倍氯米松福莫特罗”“异丙托溴铵”“噻托溴铵”“乌美溴铵-三苯乙酸维兰特罗”等;采用主题词与自由词结合的方式进行检索。
1.2.4 资料筛选与提取
由两名研究者独立筛选文献及提取资料,并交叉核对;若遇争议,由第三人裁定。提取内容包括:(1)国内外呼吸系统吸入制剂上市情况,包括国家/地区、上市时间、药品类型、药物名称、适应证、生产厂家等;(2)国内外呼吸系统吸入制剂临床试验开展情况,包括研发国家/地区、研发目的、试验名称、注册号、药物名称、适应证、作用机制、药物类别、试验分期、患者招募状态、试验开始及结束时间等;(3)吸入制剂研发临床试验设计和评价相关内容。
1.2.5 资料分析方法
采用描述性分析方法,描述呼吸系统吸入制剂的研发现状。
2、结果
2.1 基于二次研究证据的系统评价结果
2.1.1 文献检索结果
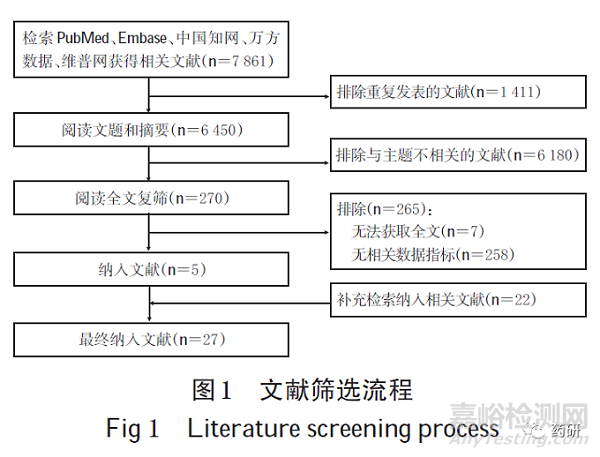
初检得相关文献7 861 篇,经逐层筛选后,最终纳入文献5 篇;补充检索纳入文献22 篇,最终纳入27 篇文献。文献筛选流程见图1。
2.1.2 呼吸系统吸入制剂的市场情况
(1)从剂型角度分析。艾昆纬(IQVIA)公司的一项有关2013-2019 年全球吸入制剂剂型趋势变化的报告显示,全球各剂型按销售金额统计,粉雾剂占46%,气雾剂占32%,雾化吸入溶液占22%;而中国市场却呈现出不同的情况:按销售金额统计,雾化吸入溶液占73%,粉雾剂占25%,气雾剂只占2%不到[9]。
(2)从市场份额角度分析。一项调查研究报告显示,吸入制剂海外市场集中度高,英国GSK、德国BI、英国AZ等3 家大型制药公司在2018 年的全球市场份额合计约为70%。其中,英国GSK公司的市场份额最高,约为40%;其次是英国AZ公司和德国BI 公司,市场份额均约为20%。中国吸入制剂市场中则主要以进口产品为主[8]。
(3)从品种角度分析。《2019 年全球及中国吸入制剂行业市场规模及企业竞争格局分析》显示,国外吸入制剂市场有五大产品,包括沙美特罗替卡松吸入剂(舒利迭)、吸入用布地奈德混悬液(普米克令舒)、布地奈德福莫特罗粉吸入剂(信必可都保)、硫酸沙丁胺醇吸入气雾剂(万托林)和噻托溴铵粉吸入剂(思力华);而我国吸入制剂目前仍以进口药为主,在研产品多为仿制药,国内企业布局较多的4 种吸入制剂为沙美特罗替卡松吸入剂、噻托溴铵、布地奈德、布地奈德福罗莫斯[8]。
2.1.3 吸入制剂的仿制障碍
(1)研发障碍。吸入制剂是药学、吸入动力学、颗粒动力学、流体力学、表面科学和吸入器设计加工等多种技术的结合,研发难度极大。首先,在处方设计方面,主药、抛射剂、助溶剂、表面活性剂等的配比对药物的抛射动力和稳定性、药物粒度和每喷含量等的影响较大,同时由于给药量小(通常几百微克),其生物等效性试验开展的难度较大;第二,在药物粒度方面,药物粒度通常在7 μm以下,故所用原料药需要进行微粉化处理,工艺难度大;第三,在药物分散方面,药物的不同分散状态(分子、胶体、微晶体、非晶态等)对其在肺部的沉积有不同的影响;第四,在精密灌装和喷射工艺方面,因吸入剂型每喷药物含量较低,需要非常精密的灌装工艺才能保持每喷含量的稳定;第五,在吸入装置方面,理想的吸入装置应具有使用方便、价格便宜、药物剂量输出稳定、药物输出微粒直径适当(2~5 μm)和可计量等特点,且吸入制剂是药械合一的特殊制剂,对药械联用要求很高;最后,在评价维度方面,吸入剂的评价维度多样且复杂,包括吸入剂的空气动力学粒度分布、递送剂量均匀度(气雾剂、喷雾剂还需研究喷雾模式和气雾特征)等,仿制难度大[10-13]。
(2)临床试验障碍。临床试验的难度主要在于受试者自主用药控制性差,容易多吸或少吸。吸入制剂对受试者操作要求高,操作不当容易导致喷嘴过紧、不能完全包含吸嘴、误通过鼻吸入、吸入过快、药物沉积在口腔等问题。由于吸入制剂的剂量较小(微克水平),进入肺部的药物实际剂量更小。因此,如果在用药过程中患者使用不当,将会对试验结局产生较大影响[8]。
(3)审批障碍。吸入制剂通常需要药械联合申报,因此申报材料需综合考量药品的工艺、吸入装置、主药专利情况和吸入制剂的生物等效性试验等[13]。2020 年12 月,国家药品监督管理局药品审评中心发布了《经口吸入制剂仿制药生物等效性研究指导原则》,为今后规范和指导经口吸入制剂仿制药生物等效性研究提供了依据[14]。
(4)生产障碍。吸入制剂产业化投入高、总体产能不足。由于大部分吸入制剂的药物活性成分不能耐受高温灭菌,导致其无菌生产的设备造价高昂;同时,国内企业部分核心生产设备如干粉剂粉末定量分装设备等仍依赖进口,限制了国内相关制剂生产的产能扩张[9]。
2.1.4 吸入制剂研发相关的指南及政策制度现状
美国FDA分别于2002 年和2003 年制定了吸入制剂的相关政策,用以指导3 种吸入制剂(气雾剂、干粉吸入剂和供雾化吸入溶液/混悬液)的研发[15-16];后又于2018年发布了一部行业指南《定量吸入器(MDI)和干粉吸入器(DPI)药品—— 质量考虑》[Metered Dose Inhaler (MDI)and Dry Powder Inhaler(DPI)Drug Products——Quality Considerations],就气雾剂和干粉吸入剂产品开发的质量控制提供了相应建议[17]。针对吸入制剂的仿制药一致性评价,美国FDA已先后出台了包括硫酸沙丁胺醇、异丙托溴铵、酒石酸左旋沙丁胺醇、布地奈德/富马酸福莫特罗和丙酸氟替卡松/沙美特罗共5 个产品的指南草案[18-22]。
欧盟EMA于2006 年制定了吸入制剂的相关政策,用以指导3 种吸入制剂(气雾剂、干粉吸入剂和供雾化吸入溶液/混悬液)的研发[23];同时,EMA于2009 年发布了《口吸入制剂临床文件要求的考虑要点》(Guideline on the Requirements for Clinical Documentation for Orally Inhaled Products),对吸入制剂的临床研究相关文件也进行了较为细致的规范[24]。
近年来,我国发布了一系列有关促进国产药品创新和医疗器械国产化的支持政策,以帮助促进吸入制剂的国产化研发,打破跨国企业的垄断地位。如2007 年,国家食品药品监督管理局发布了《关于吸入制剂质量控制等5 个药物研究技术指导原则的通知》[25];2011 年,国家食品药品监督管理局发布了《关于印发已上市吸入气雾剂变更抛射剂研究技术要求的通知》[26];2020 年,国家药品监督管理局药品审评中心发布了《经口吸入制剂仿制药生物等效性研究指导原则》[14]等。国家除了在审批上市方面为国产药品开通快速通道以外,在国内医保采购方面也推出了一系列政策文件来推进国产药品和国产医疗器械的临床使用[27]。
2.2 基于原始研究证据的系统评价结果
检索各国/地区药品监督管理平台和药智网,获得欧盟、美国、加拿大、日本、中国批准上市的呼吸系统吸入制剂信息和中国正在注册审批中的药品信息。检索各临床试验注册平台,由于无剂型检索条目,临床试验数量过多难以筛选,故本研究通过药智网获得国外正进行的呼吸系统吸入制剂临床试验开展情况。同时,通过中国药物临床试验登记与信息公示平台检索中国正进行的呼吸系统吸入制剂临床试验情况。
2.2.1 上市的呼吸系统吸入制剂情况
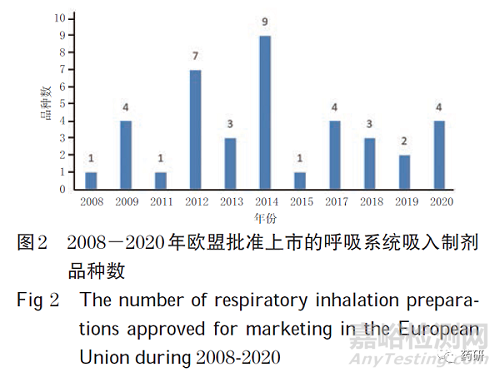
(1)欧盟。从品种数分析,截至2020 年8 月,欧洲EMA数据显示,在欧盟上市的呼吸系统吸入制剂共39种。2008-2020 年欧盟批准上市的呼吸系统吸入制剂品种数见图2。从类别分析,吸入制剂以复方制剂为主,共22 种(56.4%,其中二联制剂15 个、三联制剂7 个),单方制剂共17种(43.6%)。
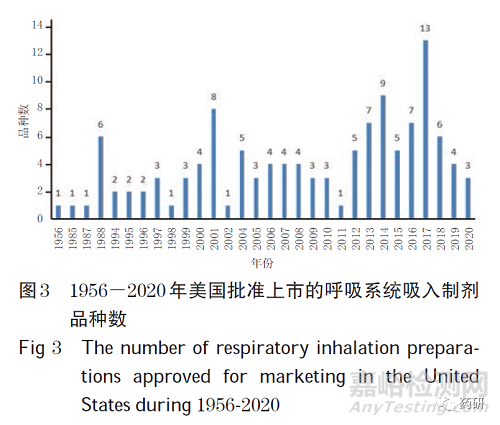
(2)美国。从品种数分析,药智网数据显示,截至2020 年8 月,在美国上市的呼吸系统吸入制剂共121 种(美国FDA官网由于无剂型检索条目,故未能从其官网获得上市的呼吸系统吸入制剂情况)。1956-2020 年美国批准上市的呼吸系统吸入制剂品种数见图3。从类别分析,121 种吸入制剂以单方制剂为主,共101 种(83.5%);其余为复方制剂,共20 种(16.5%,其中二联制剂18 个、三联制剂2个)。
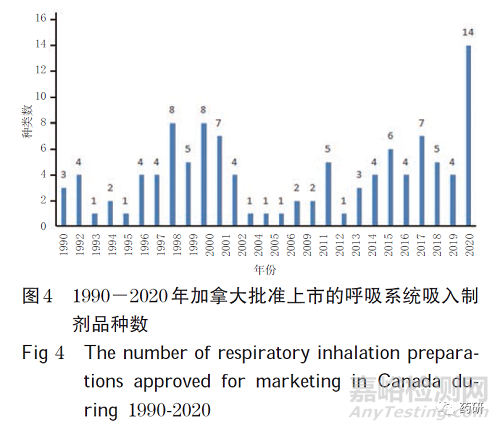
(3)加拿大。从品种数量分析,加拿大HC 官网显示,截至2020 年8 月,在加拿大上市的呼吸系统吸入制剂共111 种。1990-2020 年加拿大批准上市的呼吸系统吸入制剂品种数见图4。从类别分析,111 种吸入制剂以单方制剂为主,共81 种(73.0%);其余为复方制剂,共30 种(27.0%,其中二联制剂28 个、三联制剂2 个)。
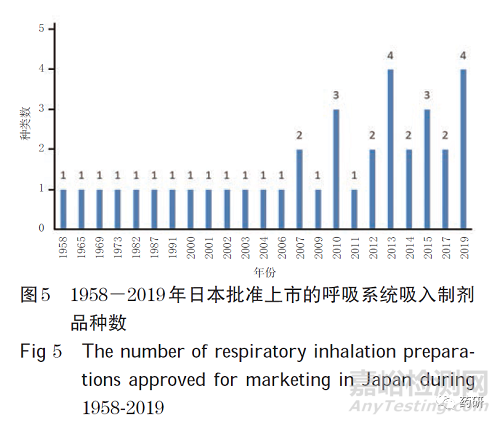
(4)日本。从品种数分析,药智网数据显示,截至2020 年8 月,在日本上市的呼吸系统吸入制剂共37 种(因日本PMDA无剂型检索条目,故未能从其官网获得上市的呼吸系统吸入制剂情况)。1958-2019 年日本批准上市的呼吸系统吸入制剂品种数见图5。从药物类别分析,日本市场的37 种呼吸系统吸入制剂以单方制剂为主,共27 种(73.0%);其余为复方制剂,共10 种(37.0%,其中二联制剂7 个、三联制剂3 个)。
(5)中国。从品种数量分析,我国NMPA官网显示,截至2020 年8 月,在我国上市的呼吸系统吸入制剂共149 种,国产药品69 种(46.3%),进口药品80 种(53.7%)。鉴于NMPA 官网未能显示药品首次获批日期,故本文未展示每年批准上市的药品数量。从类别分析,69 种国产呼吸系统吸入制剂以单方制剂为主(共67种,97.1%),复方制剂仅2 种(2.9%,均为二联制剂);80种进口呼吸系统吸入制剂以单方制剂为主(共58 种,72.5%),复方制剂仅22 种(27.5%,其中二联制剂19 个、三联制剂3 个)。
2.2.2 在研呼吸系统吸入制剂临床试验情况
(1)国外情况。首先,从数量分析,药智网数据显示,截至2020 年8 月,国外在研的呼吸系统吸入制剂临床试验共511 项,其中463 项(90.6%)同时在多个国家开展。其次,从申办机构分析,本研究检索到的国外开展呼吸系统吸入制剂的申办机构共98 家,包括生产企业、高校、医院等。登记临床试验最多的前5 家生产企业为瑞士Novartis(NVS)公司(80 项)、英国GSK 公司(72项)、意大利Chiesi 公司(63 项)、英国AZ公司(57 项)、德国BI 公司(37 项)。再次,从试验阶段分析,最多的是Ⅲ期临床试验(362 项,70.8%),其次是Ⅱ期临床试验(114项,22.3%)、其他(20 项,3.9%)、Ⅰ期临床试验(15 项,2.9%)。最后,从适应证分析,临床试验数量排序依次为COPD(215 项,42.1%)、哮喘(162 项,31.7%)、囊性纤维化(40 项,7.8%)、感染性疾病(35 项,6.8%)、其他(28项,5.5%)、支气管扩张症(20 项,3.9%)、肺动脉高压(11项,2.2%)。由于国外多个药物是采用代码,故本研究未能按药物类型分类描述。
(2)国内情况。第一,从数量分析,中国药物临床试验登记与信息公示平台显示,截至2020 年8 月,我国正在进行或已批准但尚未开始的临床试验共69 项。第二,从申办机构分析,本研究检索到的在国内开展的呼吸系统吸入制剂临床试验涉及机构共47 家。其中,国内机构共39 家,包括27 家企业和12 家医院,共登记临床试验59 项(85.5%);国外机构共8 家,全部为企业,共登记临床试验10 项(14.5%)。登记临床试验数量位居第1 位的是四川大学华西医院(7 项,10.1%),其次依次是四川普锐特药业有限公司(6 项,8.7%)、银谷制药有限责任公司(4 项,5.8%)、重庆科瑞制药(集团)有限公司(3 项,4.3%)。第三,从试验阶段分析,国内吸入制剂临床试验主要集中在生物等效性试验(25 项,36.2%)和Ⅲ期临床试验(22 项,31.9%),其次是Ⅰ 期临床试验(4 项,5.8%)。第四,从适应证分析,国内吸入制剂临床试验主要集中在COPD(24 项,34.8%)和哮喘(18 项,26.1%),其他还包括支气管炎(11 项,15.9%)、吸入性肺炎(4 项,5.8%)、哮喘-COPD 重叠综合征(4 项,5.8%)、肺损伤(1项,1.4%)、支气管扩张症(1 项,1.4%)、支气管肺发育不良(1 项,1.4%)等。第五,从药物类别分析,国内吸入制剂临床试验以支气管扩张剂为主(34 项,49.3%),其次是吸入性糖皮质激素(ICS)(16 项,23.2%)和化痰药(11项,15.9%)等。其中,单纯支气管扩张剂包括长效抗毒蕈碱药(LAMA)(11 项,15.9%)、长效β 2 受体激动剂(LABA)(7 项,10.1%)、短效抗毒蕈碱药(SAMA)(4 项,5.8%)和短效β2受体激动剂(SABA)(4项,5.8%);复方支气管扩张剂包括ICS/LABA(4 项,5.8%)、LABA/LAMA(3 项,4.3%)和LABA/LAMA/ICS(1 项,1.4%)。
3、讨论
由本研究数据可以看出,在呼吸系统吸入制剂的市场情况方面:从剂型角度分析,2013-2019 年,全球各剂型按销售金额统计,粉雾剂占46%,气雾剂占32%,雾化吸入溶液占22%;从市场份额角度分析,英国AZ、德国BI 和英国GSK等公司的市场份额合计约70%。呼吸系统吸入制剂上市品种数量方面:欧盟上市39 种,美国上市121 种,加拿大上市111 种,日本上市37 种,中国上市国产吸入制剂69 种、进口吸入制剂80 种。在研呼吸系统吸入制剂正进行的临床试验:国外有511 项,中国有69 项。呼吸系统吸入制剂仿制障碍主要包括研发、临床试验、审批和生产障碍。目前,我国通过一系列政策对国产药品创新和医疗器械国产化提供支持,将有助于促进吸入制剂的国产化研发。
同时,由本研究统计结果也可得出,我国吸入制剂未来研发方向可考虑如下方面:在药物联用研发方面,我国国产呼吸系统吸入制剂以单方制剂为主,复方制剂较少且均为二联用药,尚无在三联用药领域的研发布局。随着技术手段的不断突破和国内研发力度的不断加强,三联用药领域值得关注[11]。在药物适应证研发方面,国内临床试验适应证主要关注COPD、哮喘、支气管炎等,国外临床试验在此基础上还关注了囊性纤维化和感染性疾病,结合国内疾病负担,相关研发机构可关注此领域。在药物剂型方面,一些新制剂,如脂质体、纳米粒、纳米乳等雾化吸入剂和智能型雾化器、定量液体吸入器的开发具有良好的前景,且如何开发出既便宜又适合雾化吸入的制剂仍是医疗界需努力的方向[28]。在吸入制剂装置方面,呼吸疾病本身和雾化装置的使用不同会使雾化药物在靶部位的沉积浓度有所差异[29],因此对于不同呼吸系统疾病,如何寻找合适的方式来控制靶部位的最适药物浓度,仍需要大量的随机对照研究来进一步明确。



作者|陈哲,李雯燕,倪晓凤,潘相丞,张伶俐

来源:中国药房


