您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-09-10 20:01
摘要 目的:起草药用辅料月桂醇的质量控制标准。方法:比较国内外月桂醇质量标准,结合样品的试验结果,主要对其性状、红外鉴别和含量测定方法进行增修订。结果:建立的月桂醇质量标准已完成公示。结论:本质量标准的建立,将为月桂醇在药品中的应用提供质量保障。
关键词:月桂醇;质量标准;含量测定;气相色谱
Abstract Objective:To draft the quality standard of lauryl alcohol. Methods: In combination with the test results of sample, the property,infrared identification and assay items were added and revised by comparing domestic and international quality standards of lauryl alcohol. Results: The drafted standard of lauryl alcohol has been disclosed.Conclusion: The established standard will provide the quality guarantee for the application of lauryl alcohol in medicines.
Key words: lauryl alcohol; quality standard; assay; gas chromatography
月桂醇(lauryl alcohol),化学名为1-十二醇,作为一种药用辅料,常用于软膏剂和乳膏剂的制备。研究表明,月桂醇能对药物的透皮吸收起到一定的促进作用。由于其具有表面活性剂的性质以及特定的香味,并且化学性质稳定,较为安全,在其他剂型的制备中也常有应用。除此之外,月桂醇在洗涤剂、牙膏等日化用品中的应用也较为广泛,同时,也常作为一种食品添加剂用于食用香精的配制。月桂醇的合成通常由椰子油作为原料,主要有两种工艺:①直接高压催化加氢,得到一系列C8-C18的混合醇以及异丙醇和水,常压蒸馏后再通过减压蒸馏得到相应的组分;②先由甲醇酯交换得月桂酸甲酯,再催化加氢,蒸馏后获得。
经查阅,月桂醇在《中华人民共和国药典》(简称《中国药典》)、USP、JP中均未收载。BP2021[1]和EP10.4[2]以试剂的形式进行了收录,其均只收载了熔点、相对密度和含量测定共3个项目。另外,《美国食品化学品法典》(FCC-9)[3]以及《中国药用辅料》[4]中收载了该品种。目前,国内尚无企业获得月桂醇药用辅料的批准文号,现有的月桂醇质控指标和限度有待统一和提高。为进一步加强对药品安全性和有效性的控制,提高药品质量,解决药用辅料标准[5]缺失等问题,本文对月桂醇质量标准进行了研究和起草。
月桂醇的质量标准内容包括来源、性状、相对密度、折光率、凝点、鉴别(红外光谱和气相色谱)、酸值、醇中溶解物、含量测定、类别和贮藏项目。现将质量标准中各项目的研究情况进行报告。
1、仪器与试药
1.1 仪器
Mettler Toledo RM40折光率仪;Mettler Toledo S40 PH测定仪;PE SPEETNCM65红外分光光度计(Perkin Elmer);Mettler Toledo XA205DU 十万分之一电子天平;Agilent GC 7890N气相色谱仪、氢火焰离子化检测器。
1.2 试药
月桂醇对照品(来源Dr.Ehrenstorfer,批号:30104);无水乙醇、正十三烷均为分析纯。
本次共收集到月桂醇样品1批次,为购买所得,生产厂家为马来西亚Emery Oleochemicals公司,批号M12222010W,包装为白色塑料瓶装。
2、性状
2.1 名称
EP10.4,BP2021及FCC-9中本品英文名皆为Lauryl Alcohol,EP10.4,BP2021中分子量为186.3,而FCC-9中则更精确为186.34,参考《中国药典》的描述规则,拟定质量标准中本品中文名称为:月桂醇;英文名称为:lauryl alcohol;分子式C12H26O;相对分子质量为186.34;CAS号:。
2.2 外观性状
通过观察,样品在高于21 ℃时为无色液体,在低于20 ℃时为白色结晶体,有月桂油香气。故参照FCC-9和《中国药用辅料》,将性状描述为:本品在高于21 ℃时为无色或浅黄色液体,在低于20 ℃时为白色或类白色结晶体;有月桂油香气。
2.3 相对密度
各标准中均收载此项,BP2021和EP10.4规定本品在20 ℃下的相对密度约为0.820,FCC-9和《中国药用辅料》规定在25 ℃下的相对密度为0.830~0.836。由于在20 ℃时本品通常为固体,无法进行测定,故按照《中国药典》2020年版四部通则0601[6]下的方法,在25 ℃时测定样品相对密度,结果为0.831。将限度拟定为0.830~0.836。
2.4 折光率
FCC-9和《中国药用辅料》有收载,限度均为1.440~1.444,差异在于前者的测定温度为20 ℃,后者的测定温度为25 ℃。本品在20 ℃以下时常为固体,按照《中国药典》2020年版四部通则0622在25 ℃时测定折光率,结果为1.441,故将其限度拟定为1.440~1.444。
2.5 凝点
BP2021和EP10.4未收载此项,FCC-9和《中国药用辅料》限度为不低于21 ℃,照《中国药典》2020年版四部通则0613测定样品结果为22.6 ℃,参照已有限度及性状项下的描述,限度拟定为:不低于21.0 ℃。
3、鉴别
3.1 红外光谱鉴别
BP2021、EP10.4和《中国药用辅料》未收载此项,FCC-9有收载,并附有标准的红外光图谱。按《中国药典》2020年版四部通则0402红外分光光度法,采用KBr压片,测定样品及月桂醇对照品(Dr. Ehrenstorfer 30104)的红外光谱,结果:样品的红外光吸收图谱与对照品的图谱一致,与FCC-9标准中所附月桂醇标准图谱一致,见图1。
3.2 气相色谱鉴别
各标准中均未收载此鉴别项,考虑到标准中只有光谱鉴别一项,而含量测定采用的是气相色谱法,故增加专属性强的气相色谱鉴别,表述为:在含量测定项下记录的色谱图中,供试品溶液月桂醇峰的保留时间应与对照品溶液月桂醇峰的保留时间一致。检测样品,结果符合规定。
4、检查
4.1 酸值
BP 2021和EP10.4未收载此检查项,FCC-9和《中国药用辅料》规定限度应不得大于1.0。按《中国药典》2020年版四部通则0713脂肪与脂肪油测定法中酸值的测定法测定样品的结果为0.03,故将限度拟定为:不得大于1.0。
4.2 醇中的溶解度
BP 2021和EP10.4未收载此检查项,FCC-9和《中国药用辅料》规定:取本品1 mL,溶于70%乙醇3mL中,稀释至10 mL,保持澄清。参照已有标准该项表述为:取本品1mL,溶于70%乙醇3mL中,稀释至10 mL,保持澄清。检测样品符合规定。
5、含量测定
各标准均采用气相色谱法控制月桂醇,限度有所不同(BP2021与EP10.4:≥98%,FCC-9和《中国药用辅料》:≥97.0%)但均未提供具体的测定方法。本次起草参考各国标准和文献,建立了月桂醇含量测定的检验方法并进行方法学验证,拟定试验如下:
5.1 色谱条件
以5%苯基-95%甲基聚硅氧烷(或极性相近)为固定液;起始温度为60 ℃,维持5 min,以每分钟15 ℃的速率升温至260 ℃,维持8 min;进样口温度为260 ℃;检测器温度为280 ℃。内标物质峰和月桂醇峰的分离度应符合要求。

A.FCC-9标准图谱(FCC-9 standard IR spectrum) B.对照品(reference substance)(Dr. Ehrenstorfer 30104) C.样品(sample)(EmeryM12222010W)
图1 月桂醇标准图谱(A)、对照品(B)、样品(C)红外光谱图
Fig.1 Standard IR spectrum of lauryl alcohol (A)、 reference substance (B)、sample (C)
5.2 溶液的配制
5.2.1 内标溶液
精密称取正十三烷1.506 1 g置20 mL量瓶中,用无水乙醇(样品易溶于无水乙醇,故采用无水乙醇作溶剂)溶解并稀释至刻度,摇匀,精密量取5 mL置200 mL量瓶中,用无水乙醇稀释至刻度,摇匀,备用。
5.2.2 对照品储备溶液
精密称取月桂醇对照品(Dr. Ehrenstorfer 30104,99.7%)0.150 42 g,置10 mL量瓶中,用内标溶液溶解并稀释至刻度,摇匀,备用。
5.2.3 对照品溶液
精密量取对照品储备溶液5 mL,置50 mL量瓶中,用内标溶液稀释至刻度,摇匀,即得。
5.2.4 供试品溶液
取样品约0.075 g,精密称定,置50 mL量瓶中,用内标溶液溶解并稀释至刻度,摇匀,即得。
5.3 方法学验证
5.3.1 专属性
取对照品溶液在“5.1”色谱条件下进样测定,溶剂、正十三烷和月桂醇依次出峰,各峰间的分离度均能达到有效分离,空白溶剂不会干扰内标和主峰的检出,表明本法的专属性良好。
5.3.2 线性关系
精密量取对照品储备液0.05、0.1、0.2、1、3、5 mL,分别置10 mL量瓶中,用内标溶液稀释至刻度,摇匀。精密量取对照品储备液与上述各浓度的对照品溶液各1 μL注入色谱仪,记录色谱图。以浓度作为横坐标,待测组分峰面积与内标峰面积的比值作为纵坐标,绘制标准曲线,得线性方程:Y=0.510 2X+0.011 9,相关系数0.999 8,线性在0.075 0~14.997 mg·mL-1范围内线性关系良好。
5.3.3 检测限与定量限
量取对照品溶液逐步稀释至主成分信噪比最低检出限(S/N=3):37.49ng·mL-1;最低定量限(S/N=10):149.97ng·mL-1。
5.3.4 精密度
取对照品溶液照“5.1”项下色谱条件连续进样6次,以月桂醇峰面积与正十三烷峰面积比值计算结果(比值依次为0.7964、0.7923、0.7777、0.793 1、0.7979、0.7798),RSD为1.09%,方法精密度良好。
5.3.5 重复性
照“5.2”供试品溶液制备方法,取本品平行制备6份,照“5.1”色谱条件进样测定月桂醇的含量(分别为99.08%、100.19%、98.54%、99.20%、100.00%、99.88%)。平均含量为99.48%,RSD为0.64%,表明重复性良好。
5.3.6 稳定性
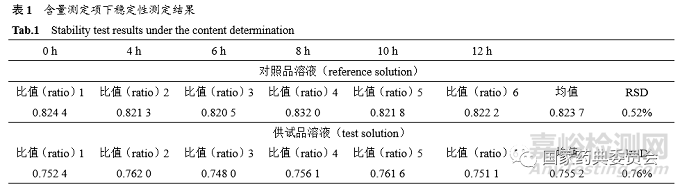
取同一份对照品溶液和供试品溶液,照“5.1”项下条件分别于0、4、6、8、10、12h进行测定,以月桂醇峰面积与正十三烷峰面积比值计算结果,对照品溶液的RSD为0.52%,供试品溶液的RSD为0.76%,表明对照品溶液和供试品溶液均在12 h内稳定,见表1。
5.3.7 色谱柱耐用性
选用了同一类型但不同厂家生产的色谱柱HP-5,30 m×0.320 mm×0.25 μm(No.19091J-413)对同一份对照品溶液进行测定,内标物质峰与主成分峰的定位、理论塔数和分离度等指标均与在Agilent DB-5,30 m×0.530 mm×3.00 μm(No.125-5034)上测得的数值较一致,色谱柱耐用性良好。
5.3.8 样品测定
精密称取征集到的样品,按新拟定方法进行测定,结果为99.56%,RSD为0.71%。
通过对含量测定-气相色谱方法的建立与验证,表明此方法准确、可行,同时参照BP2021与EP10.4,将限度拟定为98.0%~102.0%。
6、讨论
6.1 红外光谱鉴别
由于本品根据温度的不同性状会发生变化,且变化的温度节点21 ℃在室温范围内,所以试验时其性状是不固定的。因此,在试验中尝试了膜法和压片法两种样品的制备方法,试验结果表明,由于本品黏度较大,且有固体和液体两种性状混合的情况出现,采用膜法时样品量更难控制,样品的红外光谱较压片法的重复性和一致性均更差。综合考虑,在样品制备时选用了压片法。
6.2 气相色谱条件的确定
目前少有月桂醇含量测定方法的报道,各标准中只提供了含量测定的大方法和限度,没有注明方法的具体色谱条件。而本次购买的月桂醇对照品(Dr. Ehrenstorfer 30104,99.7%)使用说明书中附有对照品的纯度以及纯度测定的基本色谱条件。因此,选用以5%苯基-95%甲基聚硅氧烷为固定液的气相毛细管柱作为测定色谱柱,在其程序升温条件上进行微调,初步确定色谱条件,方法专属性试验结果良好。
6.3 气相色谱法计算方式的选择
在试验初期,选择了直接进样外标法进行样品的测定和结果的计算,结果发现由于溶剂的挥发性较强,进样体积较小等原因,方法的精密度不佳。因此,选用与月桂醇响应接近的正十三烷作为内标物,用内标法进行测定和结果计算,以消除各因素对测定的干扰,方法学验证项目均顺利地通过。
6.4 气相色谱法溶剂的选择
月桂醇易溶于乙醇、甲醇和丙二醇,不溶于水,结合各溶剂的毒性,初步选用了无水乙醇作为溶剂。同时,内标物正十三烷也能在无水乙醇中良好溶解,最终确定以常用的无水乙醇作为溶剂进行测定,为避免溶剂挥发对测定结果的影响,选用了内标法进行计算。
参考文献
[1] BP2021[S].2021.Ⅴ-A69
[2] EP10.4 Supplement[S]. 2020:5290
[3] Food Chemicals Codex[S]. 9 Ed. 2014:675
[4] 罗明生,高天惠,宋民宪. 中国药用辅料.2020年版[M]. 北京:化学工业版社,2006:903
LUO MS, GAO TH, SONG MX. Chinese Pharmaceutical Necessities. 2020 Ed.Beijing: Chemical Industry Press, 2006:903
[5] 兰奋,洪小栩, 宋宗华, 等.《中国药典》2020年版基本概况和主要特点[J]. 中国药品标准, 2020, 21(3): 185
LAN F, HONG XX, SONG ZH, et al. Overview of the Chinese pharmacopoeia 2020edition[J].Drug Stand China, 2020, 21(3): 185
[6] 中华人民共和国药典2020年版.四部[S]. 2020. 通则0601:79
ChP 2020. Vol Ⅳ[S]. 2020. Chapter0601:79
程智,谢华**
(四川省药品检验研究院,成都 611731)

来源:《中国药品标准杂志》


