您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2021-09-29 23:55
摘要
注:本文统计的数字仅针对欧盟市场
目前市场上至少 22% 的 IVD 检测将停止,如果找不到紧急解决方案来解决现有的 IVD 法规过渡问题,将会失去更多的 IVD产品。
额外的损失是可以避免和预防的。
最大的损失比例将来自中小型制造商,其中生产小批量小众产品的制造商更容易受到影响。
制造商在认证过程中面临的第一个障碍是可用的公告机构数量不足。
关键数字
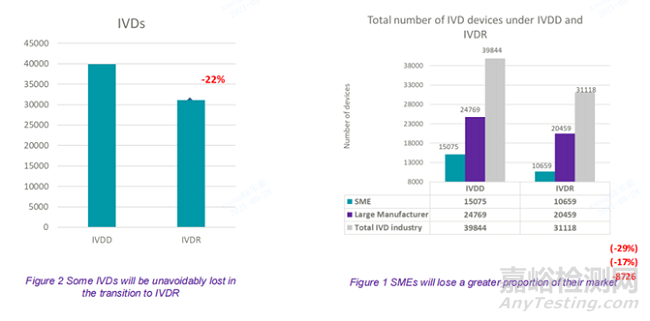
该调查覆盖了90%的市场收入;IVD产品将会不可避免的减少22%(通过比较IVDD下的器械数量和打算在IVDR下获得CE标识的器械数量)。
需要公告机构认证的检测会增加%736。
在最坏的情况下,仅有24%的产品会留存在市场上(其中许多是最低风险的 A类,不能独立使用,只能与更高级别的B、C和D类设备结合使用)。
仅有47%的制造商与公告机构签订了合作协议,以根据新的 IVDR 评估和认证其质量管理体系和 IVD;此外,这样的框架协议还不能保证公告机构可以涵盖和评估监管范围内制造商所有的产品。
MedTech Europe 调查报告——分析 2022 年 5 月新欧盟 IVD 法规适用时体外诊断医疗器械 (IVD) 的可用性
调查由医疗器械主管部门 (CAMD) 关于认证能力监测的特别小组委托进行
介绍
为配合过去 20 年技术和医疗保健的重大发展,欧盟修订了管理体外诊断医疗设备 (IVDs)的法律。现有的 IVD 指令 (IVDD) 于 1998 年首次发布,并将于 2022 年 5 月 26 日被新的 IVD 法规 (IVDR) 取代。欧盟新的 IVD 法规于 2017 年 5 月与非体外诊断医疗器械新法规同时生效。当时,欧盟的首要任务是确保建立健全、透明和可持续的监管框架并保持高度安全等级,同时支持IVDs和医疗器械的创新。
新法规旨在在医疗器械的三年过渡期(因新冠疫情延长至四年)和 IVD 的五年过渡期后取代现有指令。IVD部分的时间比MD部分多两年(现在减少到一年),以说明新的 IVD 监管要求发生了更重大和深刻的转变,需要比以往任何时候都要多的基础设施和能力。
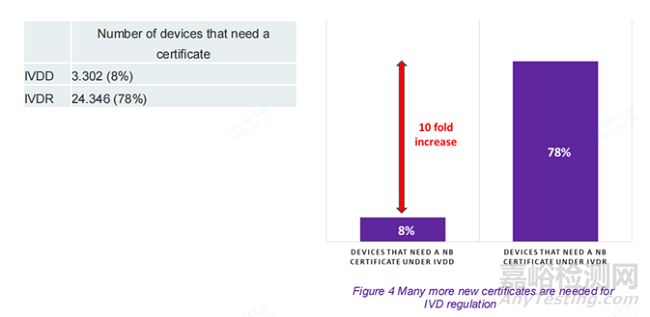
更多的IVDs产品将受到公告机构的审查,并且需要根据法规获得新的(或更新的)认证。早期的预估表明,按照 80:20 的比例划分,即80% 的设备不需要 IVDD 下的认证,而 20% 的设备需要。预计 IVDR 会将其逆转至 20:80——20% 的设备不需要认证,80% 的设备需要。本次调查的结果表明,即便如此,这也是一个低估:在 IVDD 下,实际拆分比例为 92:8,在新法规下为 22:78。即,根据 IVD 法规,需要公告机构颁发证书的设备占市场上总数的 78%,而在 IVD 指令下,这一比例仅为 8%。
由于需要证书的设备数量发生巨大变化,公告机构的能力对于欧盟 IVDR 的成功至关重要。然而现有 IVDD 指定了 18 个公告机构,但只有 6 个公告机构指定给 IVDR,其中大部分是最近指定的。另一方面,医疗器械法规近期指定的公告机构足有 22 个。
调查方法
为了准备即将由过渡到新的 IVD 监管框架,欧盟医疗器械主管当局 (CAMD) 委托 MedTech Europe 对 IVDR 市场进行调查。
在2021年7月8日至28日中,该调查发送给 MedTech Europe 的所有 IVD 制造商成员,并鼓励国家协会邀请自己的制造商成员参与,每个制造商只允许提交一份。数值结果已汇总并根据法律免责声明发布。MedTech Europe 已于 8 月 12 日向CAMD和欧盟委员会共享了一份初步报告。在该报告中,我们还包括了关于公告机构和 IVDR 过渡的个人匿名评论——个人评论不会作为本报告的一部分发布,但是,MedTech Europe 总结了该部分下的主题题为“IVDR 过渡——受访者提出的个人意见”。
115家厂商参与了本次调查. 这代表了预计90% 的市场收入覆盖率。大多数受访者 (82) 是中小型企业 (SME),33 人来自大型制造商。
结果总结
打算从 IVDD 过渡到 IVDR 的产品数量与现有指令下的 39844 个IVDs 相比,制造商希望将多达 31118 个IVDs过渡到新法规中。这意味着 22% 的 IVD 将不可避免地无法用于患者的健康服务。
最大的损失将来自中小企业制造商,其中许多制造商生产利基产品,可能无法承受业务损失。
目前尚不清楚欧盟和全球卫生系统在多大程度上为这种不可避免的损失做好了准备。
IVD指令下现有认证过渡到新的 IVD 法规– “宽限期”
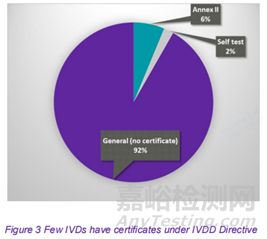
目前 92%的IVDs不需要具有公告机构的认证。在指令 (IVDD) 附件 II 中列出的或用于自检的8%的IVDs需要认证。如果颁发认证的公告机构同意,则制造商可能能够利用IVD 法规 (IVDR) 第 110(3) 条中的关于过渡期规定,最多到2024年5月的“宽限期”。
对于无法在 IVDD 下申请认证的 92% 的 IVDs,制造商没有宽限期,必须从 2022 年 5 月开始全面应用 IVDR
第 110(4) 条中关于已经在供应链中的器械的“抛售(sell-off)”条款对于有效期有限的试剂(B 、C 、D 类 IVDs)的价值非常有限。“抛售”期对于有效期较长的产品(例如仪器,其中绝大多数不需要 IVDR 认证)更为重要。
IVDR 所需的新认证的数量
作为IVDR的结果,78%的设备将需要新认证(包括需要更新现有认证的设备)。这意味着与 IVDD 相比,需要证书的 IVD 增加了 736%。此数据对于意识到需要多少公告机构来支持 IVDR 下的认证过程非常重要。
IVDR的认证状态
需要进行IVDR认证的12%IVDs已经获得了新认证。制造商预计预测这个比例到 2022 年 5 月的应用日期之前至少能提高到28%。
|
至今颁发了 IVDR 认证的设备数量 |
未提供信息的设备数量(如果可以按时颁发IVDR认证) |
到 2022 年 5 月不会颁发 IVDR 认证的设备数量 |
|
2878 |
14584 |
6874 |
虽然调查数据表明,21%的制造商在完成认证方面没有问题,但可以预计60%的产品会面临不同程度的未按时认证的风险。这是因为目前距离应用时间仅剩不到九个月,而公告机构预测新认证的颁发时间为 10 到 14 个月。理想情况下,制造商在颁发证书后需要大约六个月的时间来制造和标识设备,以便将测试菜单的可用性传达给实验室和医疗保健专业人员,将设备提供给供应链并确保为用户提供一致的可用性,而注册设备以出口到国际市场可能需要长达 12 个月的时间。
某些IVDs需要额外的认证程序
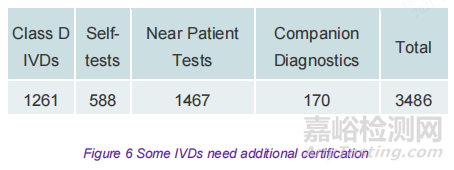
对于某些 IVDs,在公告机构颁发所需的认证之前需要额外的流程。其中包括 D 类 IVDs、伴随诊断和用于自检或近患检验的设备。所有这些设备都需要单独的欧盟技术文件评估;D类和伴随诊断进一步需要特定机构在认证过程中干预。由于公告机构工作量增加和容量不足,这些 IVDs 可能会因认证延迟而受到不同程度的影响。在最近的发布,由于缺乏认证所需的基础设施和时间,D类设备将于 2022 年 5 月获得认证会增加不确定性。
最好和最坏的情况
在从 IVDD 过渡到 IVDR 的过程中,制造商预测,在欧盟市场将失去最少目前22%的IVDs。如果不立即采取行动,预计会失去更多产品。在这里,我们提出了最好的情况和最坏的情况,以详细说明损失的潜在程度。
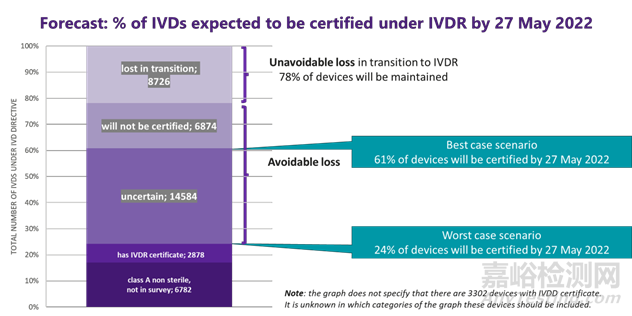
我们计算出已有IVDR认证的产品、A类非无菌的IVDs以及不在上图里有IVDD认证的产品数量占24%欧IVD 市场的份额,其中3302 拥有现有 IVDD 认证的 IVDs可能有资格享受宽限期的资格;如果不采取任何措施,在最坏的情况下,这些可能是IVDR应用日期后所有可用的设备(当然,预计到 2022 年 5 月会有一些额外的认证)。重要的是要了解 A 类设备本身不足以提供 IVD 医学检测;A 类 IVD(例如仪器、仅驱动和影响的软件、缓冲溶液、其它附件)几乎总是需要与一种或多种 B、C 或 D 类试剂结合使用。
如果不采取进一步行动,即使在最好的情况下,我们预测从 2022 年 5 月起欧盟市场39%的IVDs将无法使用。
认证阻碍:公告机构的能力
本调查提供了定量和定性数据,以说明为什么在 2022 年 5 月,公告机构认证涵覆盖IVDs如此之少。53%的受访者未与公告机构达成协议。即使有协议,也不能保证在 IVDR 应用之日及时认证哪些或多少设备。74%的受访者发现在开始或完成认证方面存在一些障碍。在这里,公告机构的能力和其他基础设施的缺乏是制造商对此的回应。
|
阻碍 |
所占百分比 |
含义 |
|
尚未指定 |
29% |
制造商正在与IVDD下但未被IVDR指定的公告机构合作 |
|
回应时间延迟 |
26% |
公告机构的回应有延迟 |
|
申请未被接受 |
20% |
制造商已经向公告机构递交申请,但申请被拒绝 |
|
无法赶上最后期限 |
15% |
公告机构已提醒制造商,他们的部分或所有产品无法在2022年5月之前获得认证 |
|
选择性认证 |
10% |
公告机构无法处理某些器械的申请(如D类、CDx等),或要求制造商确认哪些器械需要优先认证 |
许多制造商一直在 IVDD 和/或 ISO 13485 下与尚未在 IVDR 下指定的公告机构合作。由于需要重新进行 ISO 13485 认证并根据新的公告机构程序调整文档,因此过渡到新的公告机构需要一定的时间。
对于其它制造商,公告机构对合同和协议请求的响应时间被延迟,或者请求被公告机构拒绝。在有协议的情况下,一些制造商指出,他们的公告机构警告他们,并非所有产品都能在申请之日获得认证;即使制造商已完成必要的工作以准备新的认证,也有需要对产品进行优先排序。
认证阻碍:其他基础设施的缺失
其他缺失的基础设施问题包括 EUDAMED、欧盟参考实验室和专家小组。许多人提到迫切需要指导文件。如果没有指导文件,制造商、公告机构和主管当局做出不一致决定所造成的风险会更大。制造商必须花费时间和金钱来制定自己的解决方案,然后在发布指南后检查解决方案是否仍然有效。调查中提到的主要指导文件包括:
1 、性能评估–调整现有的临床证据或为新产品创建新的临床证据。
2 、OEM(“原始设备制造商”)产品——许多 IVDs是由合法制造商重新贴上标签和重新命名,他们以自己的名义将设备投放市场。而某些信息是专有的,原始制造商可能不愿意因新的法律法规共享此信息制造商。目前尚不清楚这种做法如何或是否可以在 IVDR 下继续下去。
3 、D类审查——新的分类规则意味着将有许多新的D类IVDs从未获得认证,除非有通用规范,否则在颁发认证之前会受到专家小组的额外审查。IVD只有一个专家组(而医疗器械则为 10 个)。目前尚不清楚专家小组将审查什么、他们决策的依据是什么以及如何与欧盟参考实验室验证过程配合使用。
4 、伴随诊断——药品管理部门审查公告机构认证的某些方面的新要求意味着仍有相当多的关于两个组织将如何互动的不确定性(例如,共享什么信息、决策依据和时间表)。
5 、临床试验的测定——目前尚不清楚新药临床试验中使用的哪些检测方法需要满足新的 IVDR 要求。
结论
70% 的临床决策是通过 IVDs 做出的。IVDs 的影响不应被低估。我们也不应低估IVDs的损失对欧盟医疗保健系统的影响。本调查预测,从最高风险到最低风险级别的 IVDs,包括伴随诊断、自我测试和近患者测试等类别的IVDs都将受到影响。
缺乏 IVDR 基础设施是造成这种预期和可避免损失的主要原因。在新法规的早期,提高公告机构的能力、创建指南和其他基础设施似乎是可能的,但随着应用日期的临近,时间已经不够了。
IVDR 下IVDs认证的数量需要的公告机构的是IVDD的十倍。
缺少欧盟委员会立即采取的行动,欧盟会失去大约22%至76%的IVDs。
小中型企业最有可能受到影响。
本调查表明,迫切需要就 IVDR 监管框架和快速临近的应用日期采取行动,以保护和支持欧洲的医疗诊断。

来源:致众医疗器械资讯


