您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-09 14:17
在蛋白质研究中您需要确定样品中目标蛋白是否存在和蛋白大小。无论是检测或调查疾病,或者是确定基因操作实验的成功或失败,还是确定食品样品中潜在过敏蛋白的存在。为了确定您的目标蛋白质,您通常需要将它与许多其他蛋白区分开来,其中一些可能具有相似的特性或大小。蛋白质印迹(Western blot)就是一种可以提供这些分析能力的技术。
在本文中,我们将讨论WB是什么、WB实验是如何进行的、WB向我们展示了什么以及与相关分析技术有何不同。
什么是蛋白质印迹?
蛋白质印迹,有时也称为蛋白质免疫印迹,是一种基于抗体的技术,用于检测样品中特定蛋白质是否存在、大小和浓度。该技术由Harry Towbin及其同事于1979年开发,由于该技术与Southern印迹(DNA印迹)相似,因此后来将其命名为“蛋白质印迹”。
简而言之,溶液中的蛋白质通过电泳分离。转移到合适的膜后,使用目标特异性抗体探测样品。可以检测这些抗体,并与已知标准或对照相比,评估结合蛋白的大小和浓度。
蛋白质印迹实验方案(步骤)
下图1显示了蛋白质印迹的实验方法。
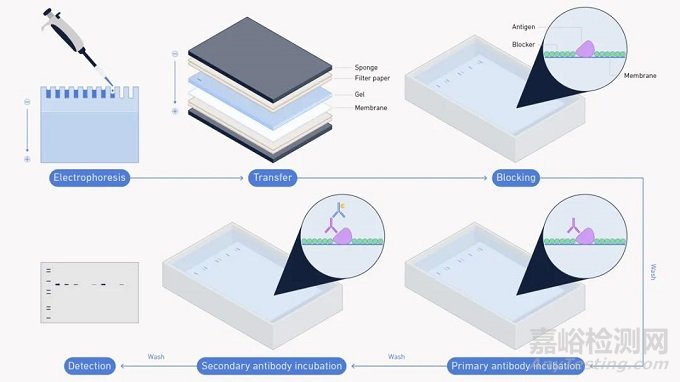
图1:蛋白质印迹实验步骤概述。
蛋白质印迹凝胶
在进行蛋白质印迹之前,必须分离样品中的蛋白质。这通常是通过蛋白质电泳实现的,例如十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)或天然PAGE,根据蛋白质的分子量或电荷分离蛋白质。选择的具体分离方法取决于分析的目的。为了获得清楚的图像,样品被离心以去除固体,以便在电泳中仅使用可溶部分的蛋白。如果您的目标蛋白在不溶部分(例如,细胞膜结合蛋白质)中,可以先研究预处理方法以首先将其释放和溶解。固体蛋白会影响凝胶的运行,目标蛋白很可能会留在浓缩胶中。
上样适当的标准样本和大小标记也很重要,以解释最终印迹的结果。
蛋白质印迹的上样控制
了解上样多少样品非常重要,尤其是在尝试比较不同样品之间的蛋白质表达时,因为仅通过印迹可能无法看出这一点。例如,在评估蛋白印迹时,一个样品的条带可能比另一个样品的亮度高两倍。这可能意味着该样品中目标蛋白的数量是其他样品的两倍,或者可能意味着一个泳道上样的样品数量或浓度更高。运行重复的蛋白质凝胶并用考马斯染色显影有助于消除这种不确定性,因为它会显示总蛋白量在每个样品通道中,可以揭示上样的不一致。检测所有样品中普遍存在的蛋白质的表达,例如全细胞和细胞质样品中的肌动蛋白,也可以用作上样对照,有助于确保蛋白质样品向膜的转移一致。但是,在比较“对照”蛋白质表达不同的模型(例如变性模型)时,这种类型的对照可能会出现问题。
蛋白质转移(印迹)
蛋白质必须从蛋白质凝胶转移到适当的膜(通常是硝酸纤维素或聚偏二氟乙烯(PVDF))以促进抗体探测。许多技术可用于转移,包括毛细管转移、扩散转移和真空印迹,但由于其速度和效率,迄今为止最常见的是电印迹(也称为电洗脱或电泳转移)。在这里,蛋白质凝胶夹在转移膜上并施加电流。来自凝胶的蛋白质被携带穿过并紧紧附着在膜上。
在电印迹中,还有多种转移策略,称为湿转移、半干转移和干转移。湿转移效率高,提供灵活的缓冲,但很耗时。半干转移速度更快,具有灵活性,但对于大蛋白质而言,效率低于湿转移。干式转印既高效又快速,但与其他方法相比灵活性较差。
可以在使用可移除的染色剂(例如PonceauS.)进行探测之前评估转移效率。
蛋白质印迹阻断
由于印迹膜对蛋白质具有高亲和力,因此在转移后阻断任何剩余的结合位点以防止随后的测定检测抗体的非特异性结合非常重要。这一步骤是通过将膜与蛋白质液体(如牛奶或血清)一起孵育来实现的。
蛋白质印迹洗涤
封闭后,重要的是在每个步骤之间清洗膜以去除多余的或未结合的试剂。洗涤不充分或不均匀会导致实验质量差、斑块印迹和高背景。然而,过度洗涤会减少目标信号,因此优化洗涤步骤的数量和持续时间很重要。确保膜被适当的缓冲液充分覆盖并轻轻搅拌以均匀洗涤膜而不会损坏它。常用的缓冲液包括Tris缓冲液(TBS)和磷酸盐缓冲液(PBS),通常包含吐温20(TBST和PBST)。
蛋白质印迹抗体
虽然可以对蛋白质印迹使用直接检测(识别目标并且可检测的单一抗体),但更多情况下使用间接方法(如下图2)。在这里,一抗用于探测膜并结合存在的任何目标蛋白。然后,使用与一抗结合且可检测的二抗。与所有步骤一样,这一步骤也需要优化,在这种情况下选择“正确”的抗体并确定最佳浓度,是良好印迹的关键。
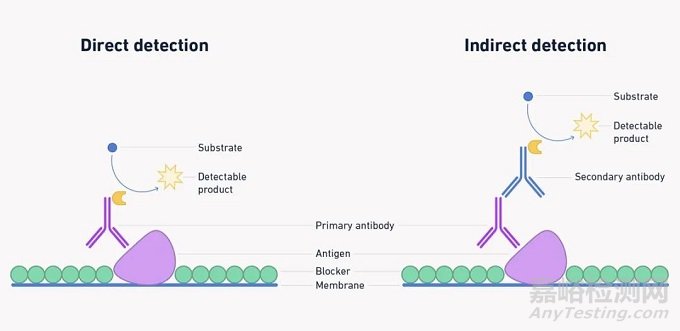
图2:直接与间接蛋白质印迹,所用示例显示化学发光检测。
蛋白质印迹二抗
当使用间接检测法时,需要将多余的未结合的一抗从膜上洗掉后使用二抗。二抗应该对一抗的种类具有特异性(例如,如果一抗来自兔,则为小鼠抗兔),并具有所选检测方法所需的偶联物。
蛋白质印迹分析
有多种检测和后续蛋白质印迹可视化的方法,包括比色、化学发光、荧光和放射性检测,总结在下图3中。
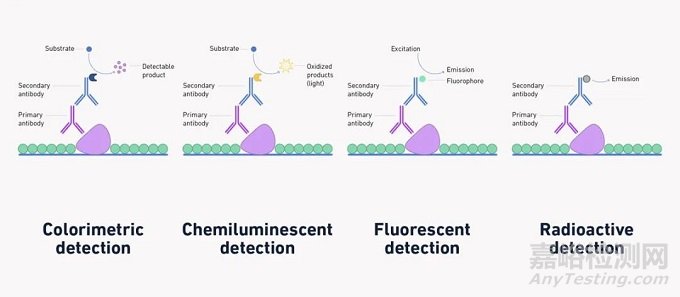
图3:使用间接方法进行比色、化学发光、放射性和荧光检测的示例。
比色和化学发光检测需要酶检测的抗体缀合,并且被认为是非常敏感的技术。辣根过氧化物酶(HRP)和碱性磷酸酶(AP)是最常用的酶,HRP由于其稳定性、对大多数结合的适应性和低成本而受到普遍青睐。在检测过程中,将底物添加到膜上,结合酶作用于该底物,引起化学变化。如果进行比色检测,则选择显色底物,该底物将产生可直接可视化和成像的变化。然而,及时对印迹成像很重要,因为印迹干燥后颜色会褪色。在化学发光检测中,产生的信号仅在酶和底物之间发生反应时持续(通常为1-24小时)。在此期间,可以通过曝光X射线胶片或使用数字成像进行永久记录来记录信号。
在荧光检测中,检测抗体与荧光团而不是酶结合。当特定波长的光照射在它们上时,它们会被激发并发出不同特定波长的光。然后可以使用数字成像器(例如光电二极管(APD)、光电倍增管(PMT)或电荷耦合器件(CCD)相机)直观地捕捉到这一点。虽然需要专业设备来进行激发和检测步骤,但荧光检测中没有底物步骤,从而缩短了实验步骤。也可以在蛋白质印迹分析中使用多重荧光团。
过去广泛使用放射性检测,其中放射性同位素与检测抗体结合,并在X射线胶片上检测发射的辐射。然而,该技术需要特殊处理以保护人员免受辐射,而且价格昂贵并且由于放射性衰变而具有有限的保质期。因此,该技术大多已被其他可用的检测方法所取代。
蛋白质印迹剥离
剥离是从蛋白质印迹膜上去除一抗和二抗的过程。如果您希望在特定印迹上研究多个目标蛋白而不是运行多个印迹,例如在样品非常有价值或稀缺的情况下,这会很有帮助。
请注意,剥离也可能会从膜上去除一些蛋白质,因此无法在剥离前后进行定量比较,并且不应在剥离的膜上进行蛋白质缺失的检查。
如果您打算剥离印迹,建议使用PVDF膜,因为它们在剥离后比硝化纤维素更能保留蛋白质。比色检测还会留下永久性污渍,因此化学发光检测适用于该应用。
如果可能,从低pH值的温和剥离缓冲液开始,以最大限度地减少样品损失,如果不成功,则尝试通过清洁剂或加热进行更严格的剥离步骤。
蛋白质印迹结果和定量
使用X射线胶片从蛋白质印迹实验中获得结果时,通常需要曝光多张胶片以优化曝光和显影时间。时间不够长,样本带可能很暗或根本不可见。时间太长,背景信号变得太强,条带合并在一起,所得印迹非常暗且难以分析。与目标浓度不平衡的对照或大小标记也可能存在问题,其中一个在另一个足够可见之前曝光过度。然后可以将胶片数字化以使用分析软件进行进一步分析。
使用X射线胶片的检测方法被认为是定性或半定量的。将样品泳道中的条带与对照和大小标记进行比较有助于确定样品中目标的存在与否。然而,如果需要定量,例如使用基于CCD相机的设备进行数字成像,由于其更大的动态范围、更高的灵敏度和更高的分辨率,提供了更好的选择。无需重复耗时的X射线胶片曝光和显影,即可微调曝光时间,从而优化信噪比。然后可以轻松地将其输入到可以分析并比较数据的软件中。
蛋白质印迹故障排除
蛋白质印迹实验方案中存在许多出错的机会,在此我们重点介绍一些常见问题并提供潜在的解决方案。
凝胶上蛋白质条带的分离不充分/定位不佳——优化蛋白质凝胶百分比和运行时间以适合您的目标蛋白。
印迹上没有任何东西,甚至两marker都没有——确保印迹套件按正确的顺序放在一起,并且电流以正确的方向运行,否则您的样品会印迹到缓冲液中。
印迹看起来凌乱、斑驳——确保在设置转移时凝胶和膜之间没有气泡。确保膜完全浸没并在孵育和洗涤步骤中轻轻混合,以产生均匀的结果。或者使用新鲜的封闭试剂。
高背景——封闭或洗涤可能不够。
对照样品的结果与预期结果不一致——优化抗体选择/浓度以最大限度地减少非特异性/脱靶结合。检查您的实验假设和概念。
在最终印迹上很难看到条带(太暗或太亮)——优化检测阶段的显影时间以增加或减少信号强度。如果条带太亮,也可能表明洗涤过度。优化抗体浓度并考虑您选择的抗体也可能有所帮助。
Southern印迹与蛋白质印迹
蛋白质印迹旨在检测特定蛋白质,而Southern印迹于1975年开发并以其发明者Edwin Southern的名字命名,用于检测特定DNA序列。与蛋白质印迹一样,样品通过电泳分离并转移到膜上。然而,在检测之前,使用与您希望检测的区域互补的序列的DNA片段来探测膜。
Northern印迹与蛋白质印迹
Northern印迹,由James Alwine、David Kemp和George Stark于1977年开发,用于检测特定的mRNA序列。与蛋白质印迹和Southern印迹一样,进行Northern印迹的样品通过电泳分离并转移到膜上。然后将具有与感兴趣区域互补的序列的cDNA片段用作检测前的探针。
蛋白质印迹与SDS-PAGE
SDS-PAGE是一种用于根据蛋白质分子质量分离蛋白质的电泳技术,而蛋白质印迹是检测特定蛋白质存在所需的整个过程。SDS-PAGE通常是蛋白质印迹实验方案中选择的电泳技术,作为在印迹前分离样品中所有蛋白质的一种手段。
蛋白质印迹目的
检测样品中目标蛋白的存在、大小和浓度的原因有很多,这些原因可以跨越多个科学学科。除了目标的存在与否,该技术还可以评估:
蛋白质-DNA相互作用——DNA结合蛋白与特定DNA序列的连接对于转录调控过程至关重要。Southwestern印迹(类似于蛋白质印迹,除了用DNA探测膜外)可用于识别基因调控研究中的转录因子。
蛋白质-蛋白质相互作用——这些对许多基本的细胞过程至关重要。蛋白质-蛋白质相互作用的检测,使用已知的蛋白质印迹的变化远印迹,可有助于阐明细胞功能和功能障碍。
翻译后修饰(PTM)——PTM影响蛋白质折叠并因此影响功能,扩大蛋白质组多样性。然而,异常的PTM与多种因素有关。因此,他们的研究引起了研究人员的极大兴趣,蛋白质印迹提供了一种这样的工具来做到这一点。
蛋白质异构体检测——蛋白质可能在不同细胞状态下以不同的异构体表达,具有不同的活性或目标。或者,它们可能需要裂解才能被激活。
抗体表征——当抗体作为工具或疗法生产时,它们的验证和表征对确保正确的性能和安全性至关重要。作为一种基于抗体的方法,蛋白质印迹是该过程中的一项有用技术。
表位作图——了解抗体如何以及在何处结合其靶蛋白对于研究、诊断和治疗目的很有价值。有许多工具可用于实现这一目标,并且由于其特殊性,蛋白质印迹就是其中之一。
亚细胞蛋白定位——对不同细胞组分进行蛋白质印迹分析可以确定目标蛋白在细胞中的位置。单细胞蛋白质印迹在该领域提供了很好的见解,并克服了其他单细胞检测所遇到的一些抗体交叉反应问题。
下面讨论一些常见的应用。
确定蛋白质是否表达
评估基因组数据可以告诉您所讨论的生物体是否有可能产生某些蛋白质。查看转录组会告诉您相关基因是否已开启,但直到您能够检测到实际蛋白质,您才能判断它是否正在积极表达。在进行实验性基因组操作时,这非常有助于确定基因组水平的变化是否反映在蛋白质水平的预期变化(例如,与野生蛋白质相比,新蛋白质的表达、截断或表达缺失)。菌株或者细胞是否在预期的组织或位置中表达?
检测标记蛋白
在进行基因操作时,可以设计和添加标签,例如His标签和GST标签。这使得它们所附着的蛋白质很容易在所研究的物种或系统的样本中找到,从而提供有关相关蛋白质的位置和特征的信息。例如,是在某些条件下从细胞膜上裂解下来的膜蛋白。这在检查实验产生的重组蛋白时也很有用。
映射随时间或组之间的变化
对时间过程实验样品进行蛋白质印迹可以提供有关蛋白质水平随时间变化的信息,例如在不同的细胞周期阶段。同样,当比较来自不同疾病或治疗组的样本时,它可以突出蛋白质水平的变化,这可能表明疾病的根本原因或影响治疗效果。
总的来说,与PCR之类的技术相比,蛋白质印迹不被认为是一种特别的定量技术。然而,它提供的蛋白质的直接检测意味着它在确诊疾病诊断中具有很大的实用性。
非传染性疾病的生物标志物
不同的蛋白质亚型可以作为病理过程的生物标志物,例如在癌症中。自身抗体,表明自身免疫性疾病,也可能被检测到。虽然质谱法常用于检测,但仍使用蛋白质印迹等基于抗体的技术来确认高通量方法的发现。
传染病诊断
Western印迹被用于疾病确认情况下,如人免疫缺陷病毒(HIV),莱姆病,牛海绵状脑病(BSE)和曲霉病。然而,与PCR等技术相比,它非常耗时,并且在包括HIV检测在内的许多情况下已被替代分析所取代。
文章来源:
1. Towbin H, Staehelin T, GordonJ. Electrophoretic transfer of proteins from polyacrylamide gels tonitrocellulose sheets: procedure and some applications. PNAS.1979;76(9):4350-4354. doi:10.1073/pnas.76.9.4350
2. Shah NJ. Southern, western andnorthern blotting. In: Raj GM, Raveendran R, eds. Introduction to Basics ofPharmacology and Toxicology: Volume 1: General and Molecular Pharmacology:Principles of Drug Action. Springer; 2019:399-406. doi:10.1007/978-981-32-9779-1_32
3. Jensen EC. The basics ofwestern blotting. Anat Rec. 2012;295(3):369-371. doi:10.1002/ar.22424
4. Bass J, Wilkinson D, Rankin D,et al. An overview of technical considerations for western blottingapplications to physiological research. Scand J Med Sci Sports.2017;27(1):4-25. doi:10.1111/sms.12702
5. Welinder C, Ekblad L.Coomassie staining as loading control in western blot analysis. J Proteome Res.2011;10(3):1416-1419. doi:10.1021/pr1011476
6. Eaton SL, Roche SL, LlaveroHurtado M, et al. Total protein analysis as a reliable loading control forquantitative fluorescent western blotting. PLoS One. 2013;8(8):e72457. doi:10.1371/journal.pone.0072457
7. Goasdoue K, Awabdy D, BjorkmanST, Miller S. Standard loading controls are not reliable for western blotquantification across brain development or in pathological conditions. Electrophoresis.2016;37(4):630-634. doi:10.1002/elps.201500385

来源:药时空


