您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2021-10-10 21:58
可用性工程之行业背景
随着全球经济日益繁荣,医疗器械行业发展迅速,行业发展使人类生命健康受益的同时也暴露出风险。使用错误带来的风险也日渐突出。为了降低此类风险保障用户安全及产品有效性,可用性工程(usability engineering),即人因工程(human factors engineering)应用在医疗器械整个生命周期都是不可或缺的。
可用性工程之法规要求
继上述行业背景,可用性工程应用越来越多的被纳入医疗器械行业法规要求。
|
法规描述 |
条款解读 |
|
ISO 13485:2016 |
7.3.3 a) 条款规定设计开发输入应根据预期用途确定可用性要求。 |
|
7.3.9 条款规定设计变更应确定变更对器械可用性影响的重要度。 |
|
|
MDD 93/42/EEC |
附录一<基本要求>中 1条款规定器械的设计及制造应尽可能降低因人体工程学造成使用错误的风险。 9.2条款规定 10.2条款规定 13.1条款规定 |
|
FDA 人因及可用性工程用于医疗器械指南 |
CDRH要求制造商设计开发应考虑可用性测试,递交申请应包含这部分数据。 |
可用性工程之应用过程
概括来说可用性工程应用就是风险管理过程,只不过是针对用户界面的风险管理。这里用风险管理的思维来概括下可用性工程的应用过程。
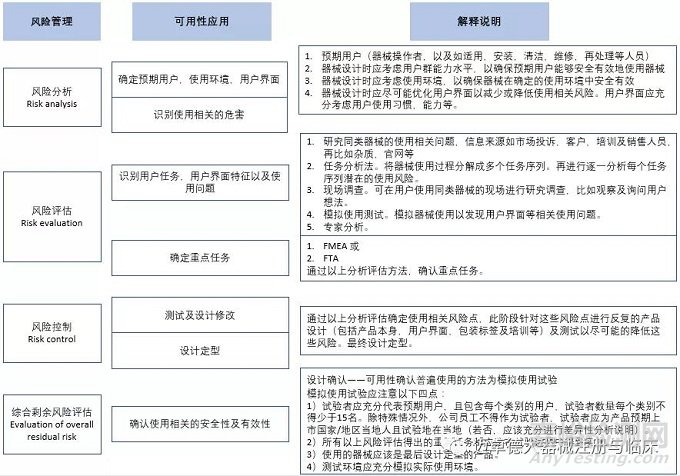
以上是概括性地描述了医疗器械中可用性工程的应用,其中可用性确认的模拟使用试验也是非常重要的模块,以及上市后可用性工程的应用需要进一步更加详细的讲解。期待续集哦。。。
最后列出几个可用性工程的法规供大家参考:
IEC 62366-1 Medical Devices-Part 1: Application of usability engineering to medical devices
IEC 62366-2 Medical Devices-Part 2: Guidance on the application of usability engineering to medical devices
FDA Guidance- Applying Human Factors and Usability Engineering to Medical Devices
MHRA- Human Factors and Usability Engineering – Guidance for Medical Devices Including Drug-device Combination Products

来源:德大器械产业管家


