您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-22 20:42
Abstract Objective: To improve the assay method of Shangshi Qutong Ointment. Methods: Gas chromatography with hydrogen flame detector were used for determination. A GC method for the simultaneous determination of 5 volatile components such as camphor was established. Results: The good linear relationships and resolutions of camphor, menthol, borneol,isoborne and methyl salicylate were obtained. Conclusion:The improved assay method for Shangshi Qutong Ointment is feasible,and benefits quality control of the product.
Key words: Shangshi Qutong Ointment; assay;camphor; GC
伤湿祛痛膏是由生川乌、生草乌、麻黄、苍术、当归、白芷、干姜、山柰、八角茴香、薄荷脑、冰片、樟脑、水杨酸甲酯等13味药物组成的一种常用的橡胶膏剂,具有祛风湿、止痛的功效,主要用于治疗头痛,风湿痛,神经痛,扭伤及肌肉酸痛[1]。全国现有26个生产厂家、30个批准文号。
伤湿祛痛膏的现行质量标准共有4个,对挥发性成分的含量测定项目或缺失,或成分测定控制指标较少[2-5],不能有效的控制该药品挥发性成分,而樟脑等挥发性成分是该药品发挥疗效的重要组成部分。本文通过研究建立采用气相色谱法同时测定樟脑、薄荷脑、冰片(龙脑、异龙脑)和水杨酸甲酯等5种挥发性成分,有效地提高和改进了伤湿祛痛膏的含量测定方法,有利于提高该药品的质量。
1 仪器与试药
1.1 仪器
岛津GC-2010型气相色谱仪、梅特勒-托利多XP205型分析天平。
1.2 试药
樟脑、薄荷脑、龙脑、异龙脑、冰片对照品,批号分别为:110747-201810(98.7%)、110728-201707 (100%)、110881-201709(99.6%)、111512-201603(96.7%)、110707-201614(100%),均购自中国食品药品检定研究院;萘、甲苯、乙酸乙酯、无水硫酸钠均购自国药集团化学试剂有限公司。样品收集自全国生产企业,共计7家22批样品,分别为辽宁A公司20181104;内蒙古B公司18072701、19013102、19042202、19042301、19042401;河北C公司19042511、19042712、19042713、19042814、19042815、19042107;山东D公司20181202;黑龙江E有限公司20181103078、20181101、20181102;吉林F公司160805、170101、190101;河南G公司190501、190502、190503。
2 方法和结果
2.1 色谱条件与系统适用性
色谱柱:HP-INNOWAX毛细管柱(0.32 mm×30 m,0.25 μm);检测器:氢火焰检测器(FID);柱温:140℃;进样口温度:180 ℃;检测器温度:230 ℃;分流比为20∶1;进样量均为1 μL。理论塔板数:按内标物萘峰计算应不低于5 000[6-9]。
2.2 溶液的制备
2.2.1 校正因子测定溶液
取萘、樟脑、薄荷脑、龙脑、异龙脑及水杨酸甲酯对照品适量,其中萘为内标,加乙酸乙酯制成每1 mL含各成分质量浓度分别约为:萘1 mg·mL-1、樟脑1 mg·mL-1、薄荷脑2 mg·mL-1、龙脑1 mg·mL-1、异龙脑0.5 mg·mL-1、水杨酸甲酯1.5 mg·mL-1的混合对照品溶液,进样测定,计算校正因子。
2.2.2 供试品溶液
取样量为210 cm2,去除橡胶膏背面的盖衬,剪成长条状或小方块状,置适宜的圆底烧瓶中,加水适量至没过供试品,按挥发油测定法甲法(《中国药典》2015年版通则2204)加热提取3 h,接收溶剂为2mL甲苯,提取完成后甲苯液用3 mL乙酸乙酯稀释,并加入适量无水硫酸除去水分,滤过,使用乙酸乙酯洗涤挥发油提取器并定容至装有5 mL萘内标溶液(质量浓度为5mg·mL-1)的25 mL量瓶中。进样测定,即得。
2.2.3 阴性样品溶液
模拟伤湿祛痛膏生产工艺分别制备缺樟脑、薄荷脑、冰片、水杨酸甲酯的阴性样品,及同时缺樟脑、薄荷脑、冰片和水杨酸甲酯的阴性样品;在按照“2.2.2”项下方法制备阴性样品溶液。
2.3 专属性试验
分别取空白溶液(含甲苯的乙酸乙酯混合溶剂)、萘内标溶液、各阴性样品溶液、混合对照品溶液及供试品溶液各1μL进样,结果表明甲苯、乙酸乙酯溶剂和阴性样品均不干扰各成分的含量测定。表明本方法专属性良好,详见图1。
2.4 精密度试验
精密吸取混合对照品溶液1 μL,质量浓度分别为:樟脑1.0118 mg·mL-1、薄荷脑2.007 2 mg·mL-1、龙脑1.006 8 mg·mL-1、异龙脑0.501 3 mg·mL-1、水杨酸甲酯1.500 8 mg·mL-1;内标物萘1.000 2 mg·mL-1。重复进样6次,分别以各对照品的峰面积与内标物萘峰面积之比值计算RSD,分别为0.23%、0.08%、0.14%、0.08%,0.23%,表明仪器精密度良好。
2.5 检测限与定量限
采用信号噪声比法测定本实验的检测限与定量限,其中检测限为:樟脑0.30 ng、薄荷脑0.38 ng、龙脑0.70 ng、异龙脑0.58 ng、水杨酸甲酯1.73 ng。定量限为:樟脑1.26 ng、薄荷脑1.39 ng、龙脑1.56 ng、异龙脑1.50 ng、水杨酸甲酯3.05 ng。
2.6 线性关系考察
精密量取混合对照品溶液(质量浓度分别为:樟脑2.9674 mg·mL-1,薄荷脑6.016 9 mg·mL-1,龙脑2.713 2 mg·mL-1,异龙脑1.808 8 mg·mL-1,水杨酸甲酯4.280 8 mg·mL-1)各0.5、1、2、3、4、6、8、10mL分别置10 mL量瓶中,加质量浓度为1.000 2 mg·mL-1的萘内标溶液稀释并定容,制成8种不同浓度的混合对照品溶液。进样测定,樟脑、薄荷脑、龙脑、异龙脑、水杨酸甲酯的回归方程分别为:
Y=0.808X-0.027 2 r=0.9999
Y=0.832 6X-0.042 6 r=0.9999
Y=0.848 4X-0.030 6 r=0.9999
Y=0.716 9X-0.018 5 r=0.9998
Y=0.531 2X-0.032 4 r=0.9999
樟脑、薄荷脑、龙脑、异龙脑、水杨酸甲酯分别在0.148 4~2.967 4 μg、0.300 8~6.016 9 μg、0.135 7~2.713 2 μg、0.0904~1.808 8 μg、0.214 0~4.280 8 μg进样范围内线性关系良好。
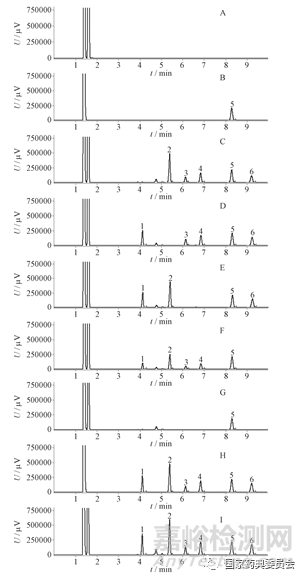
1.樟脑(camphor) 2.薄荷脑(menthol) 3.异龙脑(isoborneol) 4.龙脑(borneol) 5.萘(naphthalene) 6.水杨酸甲酯(methyl salicylate)
图1 甲苯、乙酸乙酯混合溶剂(A)、萘内标溶液(B)、缺樟脑阴性样品溶液(C)、缺薄荷脑阴性样品溶液(D)、缺冰片阴性样品溶液(E)、缺水杨酸甲酯阴性样品溶液(F)、缺樟脑、薄荷脑、冰片、水杨酸甲酯阴性样品溶液(G)、混合对照溶液(H)、样品溶液(I)气相色谱图
Fig.1 GC chromatograms of mixed solvent of toluene and ethyl acetate (A),Naphthalene internal standard solution (B), negative sample solution lack of camphor (C), negative sample solution lack of menthol (D),negative sample solution lack of borneol (E), negative sample solution lack of methyl salicylate (F), negative sample solution lack of camphor, menthol, borneol and methyl salicylate (G),mixed control solution(H), sample solution (I)
2.7 耐用性试验
稳定性试验:精密吸取同一供试品溶液(G公司,批号190501)1 μL,分别在0、2、4、6、8、10、12 h依法测定,樟脑、薄荷脑、龙脑、异龙脑、水杨酸甲酯峰面积与内标物萘峰面积之比值的RSD分别为0.10%、0.11%、0.29%、0.14%、0.16%,结果表明,供试品溶液在12h内基本稳定。
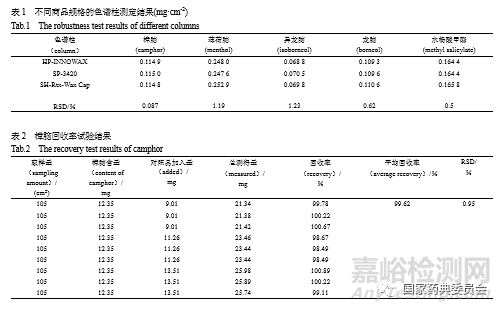
不同商品规格的色谱柱:考察三根不同商品规格的色谱柱,测定同一批号(G公司,批号190501)样品,结果见表1。表1结果表明本方法耐用性良好。
2.8 加样回收实验
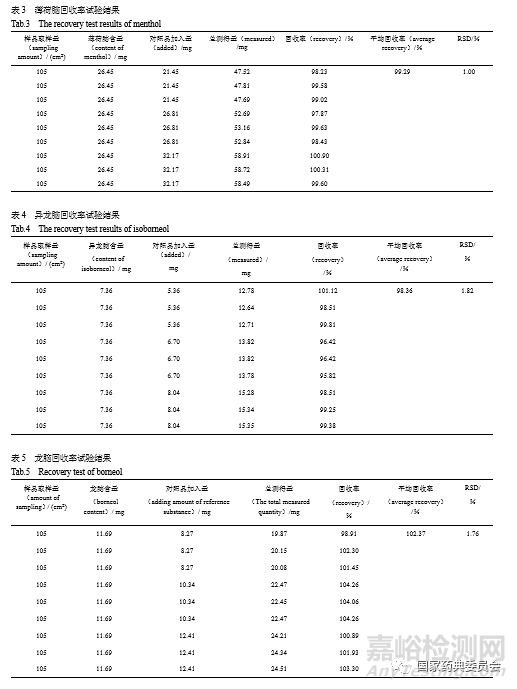
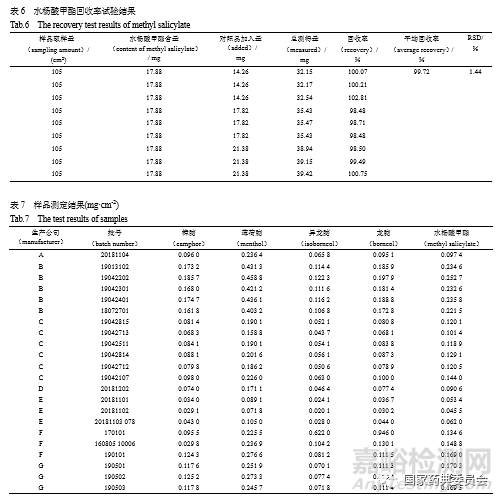
取已知含量的本品(G公司,批号:190501,樟脑含量0.117 6 mg·cm-2、薄荷脑含量0.251 9 mg·cm-2、龙脑含量0.111 3 mg·cm-2、异龙脑0.070 1 mg·cm-2、水杨酸甲酯0.170 3 mg·cm-2)105 cm2,量取9份,分别精密加入混合对照品溶液(质量浓度分别为樟脑5.629 1 mg·mL-1、薄荷脑13.404 7 mg·mL-1、龙脑5.172 3 mg·mL-1、异龙脑3.347 8 mg·mL-1、水杨酸甲酯8.912 0 mg·mL-1)1.6、2、2.4mL各3份,按“2.6”项下方法制备加样回收溶液。进样,计算回收率,结果见表2~6。
2.9 重现性
取样品(G公司,批号190501)210cm2,分别量取6份,按照上述含量测定方法测定,测定结果的平均RSD值为1.67%。
2.10 样品测定
按“2.2”项下的含量测定方法测定本品22 批伤湿祛痛膏含量,结果见表7。
3 讨论
3.1 含量测定各成分限度的拟定
经调研7家生产企业,收集到实际投料量及制成量,其中5家企业处方及制成量基本相同,B公司和E公司与其他企业处方相同但制成量差异较大,经理论值计算后,E公司偏低,B公司偏高,其余5家基本一致,考虑到各企业制成量不完全统一、工艺水平也高低不等,包装质量亦参差不齐,以及所测成分均为易挥发药物,建议本品含量限度按处方相同5家企业市售的15批平均测得含量的80%或平均理论值的80%拟定限度,也可以暂不拟定限度,待进一步考察各企业工艺历史沿革,统一处方工艺后再拟定限度。
3.2 提取时间和接收溶液的考察
本实验考察了使用挥发油提取器提取1、2、3、4、5h等不同提取时间各组分含量的异同,结果表明提取3 h后各组分含量不再增加,为最佳提取时间,故选择3h作为提取时间。挥发油接收溶液考察了甲苯、乙酸乙酯、环己烷等溶剂,结果表明甲苯作为接收溶剂,含量测定稳定性最好,故选用甲苯作为接收溶剂。
3.3 贴膏剂的取样方式的讨论
《中华人民共和国药典》2020年版贴膏剂含量测定取样方法有整张取样和按面积取样等两种方式。按整张取样的优点在于方便快捷,由于贴膏剂规定了规格,如7 cm×10 cm,取两张即140 cm2,实验时可直接进行取样,效率较高,但存在一些问题。在实验中发现,各生产企业并非严格按规格进行切片,一般会稍大于相应规格,如7 cm×10 cm规格的贴膏剂,在测量后实际为7.2 cm×10.3 cm,7.1 cm×10.2 cm等,由于贴膏剂的含量限度一般都规定为每100 cm2的含量,若仍按照整张取样计算,会产生计算取样量小于实际取样量,造成含量测定结果偏高,按面积取样则不存在上述问题,因此本实验采用按面积取样。
4 小结
通过建立气相法同时测定樟脑等5种挥发性成分的含量,拟定了相关标准限度,从而完善并提高了伤湿祛痛膏质量标准,可以更有效地保证伤湿祛痛膏药品的质量与安全。
参考文献
[1] 许兰兰.中药温熨治疗腰腿痛38例[J]. 中医外治杂志,2007,16(2):12
XU LL. Chinese medicine warm ironing treatment of 38 cases of lumbago and leg pain [J]. J Ext Therapy Tradit Chin Med, 2007, 16(2):12
[2] 卫生部药品标准.中药成方制剂第八册[S]. 1993:80
Drug Specifications Promulgated by the Ministry of Public Health. PR China. Chinese Meteria Medica Preparation. Vol Ⅷ [S]. 1993: 80
[3] 国家食品药品监督管理局国家药品标准.WS3-B-1534-93-2[S]. 2015
State Food and Drug Administration National Drug Standards. WS3-B-1534-93-2 [S]. 2015
[4] 国家食品药品监督管理局国家药品标准.S3-B-1534-93-3[S]. 2015
State Food and Drug Administration National Drug Standards. WS3-B-1534-93-3 [S]. 2015
[5] 国家食品药品监督管理局国家药品标准S3-B-1534-93-4[S]. 2015
State Food and Drug Administration National Drug Standards. WS3-B-1534-93-4 [S]. 2015
[6] 邢俊波,曹红,刘成红,等.毛细管气相色谱法测定伤湿祛痛膏中樟脑和薄荷脑的含量[J]. 药物分析杂志,2009,29(1):107
XING JB, CAO H, LIU CH, et al. Determination of camphor and menthol inShangshi Qutong ointment by capillary gas chromatography[J]. Chin J Pharm Anal, 2009, 29(1):107
[7] 袁昕蓉,李强,毕开顺.气相色谱法测定伤湿祛痛膏中4种挥发性成分的含量[J]. 中药材,2009,32(1):144
YUAN XR, LI Q, BI KS. Determination of 4 volatile components in Shangshi Qutong ointment by gas chromatography [J]. J Chin Med Mater, 2009, 32(1):144
[8] 申二永.壮骨麝香止痛膏的质量标准研究[J]. 西北药学杂志,2020,35(4):485
SHEN EY. Study on the improvement of quality standard of Zhuanggu Shexiang Zhitong ointment[J]. Northwest Pharm J, 2020, 35(4):485
[9] 田志杰.气相色谱法同时测定复方樟脑乳膏中4种成分含量[J]. 中国药品标准,2018,19(2):141
TIAN ZJ. Simultaneous determination of four constituents in compound camphor cream by GC[J]. Drug Stand China, 2018, 19(2):141
《中国药品标准》2021年第5期 第22巻
申二永1,金建闻2,李杨1
(1. 河南省食品药品检验所,国家药品监督管理局中药材及饮片质量控制重点实验室,郑州 450018;
2. 河南省食品药品审评查验中心,郑州 450018)
Investigation on the assay method of Shangshi Qutong Ointment
SHEN Eryong1,JIN Jianwen2, LI Yang1
(1. Henan Institute for Food and Drug Control, NMPA Key Laboratory for Quality Control of
Traditional Chinese Medicine and Decoction Pieces, Zhengzhou 450018,China;
2. Henan Food and Drug Evaluation and Inspection Center, Zhengzhou 450018,China)

来源:Internet


