您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-22 23:08
《国家基本药物目录》(以下简称:《目录》)是医疗机构配备使用药品的重要依据。《目录》中的药品是适应基本医疗卫生需求、剂型适宜、价格合理、能够保障供应、公众可公平获得的药品。在《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)指导下,国家药品监督管理局先后于2016年和2019年分别制定并发布了《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》和《化学仿制药参比制剂遴选与确定程序》,以便保证仿制药工作公平、公正、公开,优化工作程序,规范仿制药审评和一致性评价工作。这一系列政策的出台,标志着参比制剂备案遴选路径的正式、规范实施。
参比制剂是指已经上市的用于评价仿制药品或同类药品临床疗效等效性的对照药物制剂。随着化学仿制药参比制剂备案数量的增加,备案药品涉及的品规也越来越复杂。
本文通过对2017年3月至2021年7月国家药品监督管理局发布的仿制药参比制剂与基本药物进行匹配比对,对参比制剂备案信息的主要特征进行分析,以期了解《目录》药品参比制剂的设立情况及特点,为有序推动仿制药参比制剂的遴选提供科学依据。
参比制剂基本情况
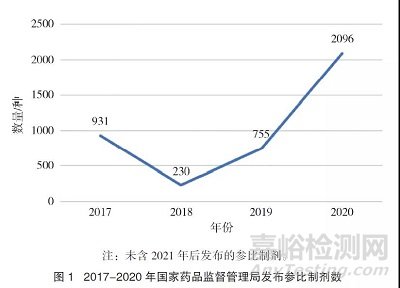
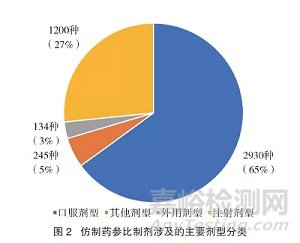
从2017年3月17日至2021年6月28日,国家药品监督管理局共计发布42批4509种参比制剂(包括不同规格、不同剂型)。2017-2020年发布品种数量详见图1。2018年至2020年间,参比制剂发布数量每年呈现近似直线增长(图1)。4509种参比制剂共涉及39种剂型,主要剂型分类如图2所示。
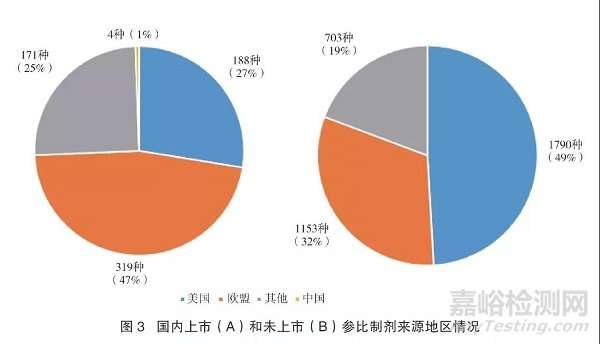
参比制剂中,682种(15%)是国内上市的原研药品,其中来自于欧盟319种(47%)、美国188种(28%)、其他地区171种(25%)、中国自主研发的药物4种;3646种(81%)是国内未上市的原研进口药,其中来自于美国1790种(49%)、欧盟1153种(32%)和其他地区703种(19%)。详见图3。
基本药物的参比制剂情况
2018年版《国家基本药物目录》中化学药品和生物制品共计417种,涉及不同规格和剂型共计1115种。417种化学药品和生物制品中,258种(62%)已经公布有相同剂型、相同规格的参比制剂共计892种。其余159种基本药物中,112种(27%)无任何对应剂型和规格的参比制剂(图4)。

仿制药参比制剂在《目录》中的情况
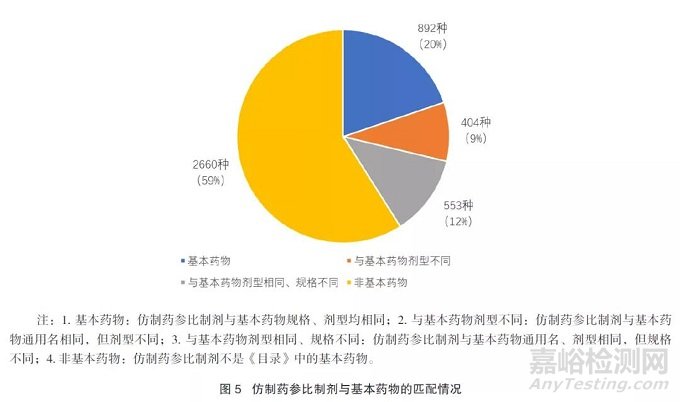
在发布的4509种参比制剂中,与基本药物具有相同通用名、相同规格、相同剂型的品种仅占20%,59%的参比制剂通用名未在《目录》中。详见图5。
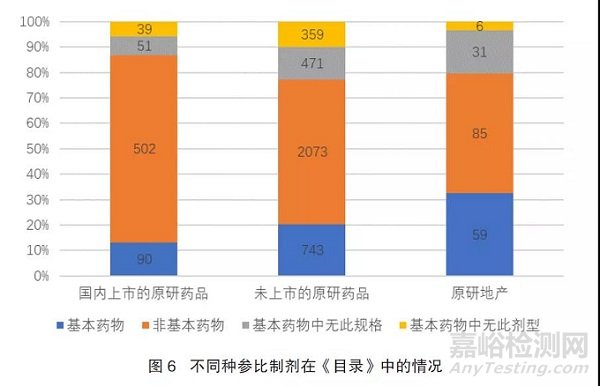
国内上市的682种原研药品作为参比制剂,其中非基本药物的有502种,占74%,为基本药物的有90种,占13%;国内未上市的3646种原研药品作为参比制剂的,其中非基本药物的有2073种,占57%,为基本药物的743种,占20%。见图6。
讨 论
《国家基本药物目录》不仅仅是一个简单的目录,它着眼于实现人人享有基本医疗卫生服务的目标,国家承诺“保障供应”。它的使用对药品生产、医疗服务、医保报销等全产业链具有重要的指导意义。本文着眼《目录》在仿制药参比制剂遴选过程中的重要指导作用,分析《目录》中各种参比制剂的情况,目的是为了更好地指导参比制剂的备案与遴选,同时也为企业仿制药的选择提供参考。
1. 基本药物中无仿制药参比制剂的比例高
本文主要分析基本药物中仿制药参比制剂的设立情况。研究结果提示,目前虽然发布的参比制剂品种繁多、剂型规格多样,远远超过《目录》中的药品数量,但是仍有27%的基本药物没有对应剂型和规格的参比制剂。这些基本药物参比制剂的缺失,导致药物一致性评价无法开展,进而阻止或者延迟了同品种仿制药的上市,限制了药品的流通和市场可及性,最终造成患者用药可及性降低,形成一种恶性循环,对保障群众用药安全带来严重影响。特别是国家实行药品集中带量采购以后,集中带量采购的药品和基本药物都是国家推荐使用的药品,并且集中带量采购药品推荐已经过评的仿制药,特别还强调一致性评价时间在前的企业优先。因此,对于无参比制剂(包括无对应剂型、规格的参比制剂)且未被带量采购的基本药物,特别是某些特定医院(如儿童医院、妇幼保健院等)需要的规格和剂型就无法得到满足,致使患者用药可及性受到严重影响。
2. 基本药物参比制剂选择和使用面临更大挑战
已发布的参比制剂大部分都不是基本药物,特别是国内已上市的参比制剂进入《目录》的比例更低。这提示国内已上市的参比制剂不容易被纳入《目录》,可能已经被仿制药所替代。另外,即使有些参比制剂通用名在《目录》中,但仍有许多该药的剂型和规格未被《目录》囊括(图6)。并且由于国内未上市的参比制剂较已上市的参比制剂具有更多的剂型、规格选择,使得国内未上市的参比制剂与基本药物在剂型上也存在较大差异。上述这些特点,都使基本药物参比制剂的选择和使用面临更大的挑战。一方面,为了保证人民群众用药安全,需要加强对基本药物参比制剂的设立,特别是目前尚无参比制剂的基本药物。只有有了参比制剂,仿制企业才能有药可仿。另一方面,是选择原研进口药物,还是原研地产化药物一直是近年来药物评价行业争论的焦点。加之针对基本药物目录,选择哪种剂型、规格的参比制剂更加适合我国人群特点、是否需要建立针对特殊人群的剂型和规格的参比制剂,都需要科学论证与决策。
总体来看,我国仿制药参比制剂目录的建立仍处于起步阶段;针对基本药物的参比制剂缺失比例仍然较大。对比美国、日本参比制剂目录和世界卫生组织(WHO)基本药物示范目录,结合本研究的分析过程与研究结果,建议不断补充针对基本药物的参比制剂。

来源:中国药事


