您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2021-11-11 13:55
国家医疗器械不良事件监测信息系统于 2019年 1月1日改版上线,2020 年度全国共收到医疗器械不良事件报告536055份[1]。与此前不同的是,所有不良事件报告均根据注册证号或备案证号主动流转到生产企业账户,企业需主动开展调查评价以履行主体责任。本研究以浙江省为例,单个企业每年收到报告数可达数千份。如何科学分析、评价和利用大量不良事件积累形成的风险“大数据”,是目前不良事件监测工作的难点,因此迫切需要引入适宜的科学统计学方法。2021年6月 1日开始实施的《医疗器械监督管理条例》(国务院令第739号)要求企业建立医疗器械不良事件监测体系,给企业提出了更高的要求[2]。本研究参考欧盟医疗器械新法规的要求,研究了基于统计学的趋势分析方法,以期为医疗器械产品上市后的监测评价和风险预警提供借鉴。
欧盟医疗器械上市后风险趋势分析方法研究
欧盟新法规关于趋势报告的要求
2017 年,欧盟颁布的新《医疗器械法规》和《体外诊断试剂法规》中,第 88 条和第 83 条明确了趋势报告(trendreporting)的要求[3]。对于医疗器械上市后监管,欧盟一方面要求企业在规定的时限内报告严重事件,另一方面要求提交针对非严重事件或预期不良副作用的趋势报告。欧盟将严重事件和非严重事件区分对待有其合理性,主管当局日常收集评估严重事件,既可缓解人力资源的不足也可提高针对性,非严重事件则由企业开展趋势分析,引入的统计学方法有助于企业和主管当局科学的判断产品风险。欧盟《医疗器械法规》于2021 年 5 月实施,相关企业需向主管当局上报趋势报告,包括出口欧盟的国内企业。
趋势报告的历史
医疗器械全球协调工作组(GHTF)于2003 年发布了《制造商不良事件趋势报告》 (Manufacturer’s Trend Reporting of AdverseEvents),2005 年将趋势报告的内容整合进《不良事件报告全球指南》(Global Guidance for Adverse Event Reporting)中[4], 此后欧盟在《医疗器械警戒系统指南》(Guidelines On A MedicalDevices Vigilance System) 中引入了趋势报告。虽然趋势报告早就已提出,由于未写入法规,无法强制企业执行。根据本研究与部分外企的沟通交流,欧盟《医疗器械法规》在2021 年实施前极少有企业主动向主管当局提交趋势报告,但新法规实施后趋势报告将成为企业的法定责任[3]。
趋势分析方法
控制图 趋势分析采用的统计学工具是控制图,可参考国家标准《控制图第 2 部分:常规控制图》(GB/T 17989.2-2020)[5]和统计质量控制相关文献。控制图是一种基于统计显著性原则进行过程控制的图形工具,广泛应用于产品、过程、服务等的质量控制[6-7]。应用控制图首先有助于评估过程是否已经达到或持续处于“受控”状态,再持续提供过程质量特性的连续记录,识别异常趋势,给出有价值的改进措施。在医疗领域,控制图常见于医疗器械产品生产过程的质量控制[8-9]、医疗器械产品使用过程的性能评估[10]、以及医疗服务质量的评估和控制[11-12]等,目前尚未见用于产品上市后风险评估和预警的报道。GHTF 的文件中仅给出了趋势分析过程的简要描述,但实践运用时,各企业还需根据医疗器械产品特点建立更加细致的分析程序,如何在实践中应用是本研究目的。
评估周期和数据来源趋势分析通常由生产企业选择某个医疗器械产品来开展,评 估周期根据产品技术特点自主选择,如周度、月度、季度等。评估周期设置过长,不利于异常趋势及风险的及时发现和控制。评估周期设置偏短可能出现数据量偏少,不利于统计分析。
医疗器械投诉指宣称已从企业的控制中放行的医疗器械存在与标识、质量、耐用性、可靠性、可用性、安全或性能有关的缺陷或宣称影响这些医疗器械性能的服务存在不足的书面、电子或口头的沟通[13]。医疗器械不良事件是指已上市的医疗器械,在正常使用情况下发生的, 导致或者可能导致人体伤害的各种有害事件[14]。考虑到投诉处置是质量管理体系中不可或缺的部分[13],且不少企业将上市后的不良事件视作投诉的表现形式之一,建议将包含不良事件在内的投诉作为趋势分析的数据来源,以确保有效数据都在风险评估范围内。参考欧盟《医疗器械法规》对趋势报告的要求[3],建议先制定严重和非严重事件的划分原则,再对其中的非严重事件开展趋势分析。
控制图类型和发生率医疗器械上市后风险趋势分析的控制图,可视为监测产品在上市后是否发生投诉事件的属性,采用计数类属性控制图中的不合格品率图(P 图)或平均不合格数图(U 图)[5]。每个评估周期内的监测为1 个子组,子组内监测数为该时间段内使用产品的数量或次数,变量数为发生投诉的次数。绘制控制图的样本值为投诉数量除以产品使用数量或次数,即投诉的发生率[4]。
投诉数量的统计较为明确,国家医疗器械不良事件监测信息系统及企业质量管理体系中有相关记录。评估周期内产品的使用数量或次数则存在一定的不确定性,通常采用估算的方式,如某医用耗材的生产销售及使用相对稳定,则可以用销售数量估算;某大型设备的装机量和日平均使用量相对稳定,则可以用平均使用次数估算。企业若能确定适宜的估算公式,则可以相对科学地计算发生率并实施趋势分析。
控制限趋势分析的控制限包括中心线(CL)、上控制限(UCL)、下控制限(LCL)。首次建立趋势分析方法时,可通过历史数据或在尝试建立控制图之前获取一系列新数据来确定适宜的控制限[5](表 1),在控制限计算公式中,①n 为每个评估周期内产品的使用量或次数,如果每个评估周期内产品使用量相同,则 n 为常量,反之n 为变量;②以投诉为例,P 和U 为多个评估周期内投诉的平均发生率,即投诉的总数除以总产品数或使用数[5]。由于部分数据可能是在未处于受控状态的基础上建立的,如果能识别出异常原因并采取纠正措施,则要剔除异常数据,重复迭代计算控制限,直到控制图不再发出异常警报。过程处于受控状态,计算的控制限才能用于对未来趋势的监测和分析。由于投诉率越低越好,医疗器械的趋势分析仅考虑上控制限。

判异准则 确定控制限的同时,可参考《控制图第 2 部分:常规控制图》(GB/T 17989.2-2020)[5]并结合产品特点给出控制图中异常趋势的判断准则,如单个样本值落在上控制限外侧、连续多个样本值处于中心线上侧、连续多个样本值持续上升等。对每一类异常趋势,需给出相应的处置方式。
趋势分析的更多形式对于所有上市后的非严重事件,还可根据产品技术特点将风险数据进一步分类,如失效模式、关键部件、危险情况等,开展更细致的分类趋势分析,以实现对产品风险的精确监测和预警。此外,可应用指数加权移动平均法(EWMA)控制图[15],通过指数加权因子平滑数据中已知、不可控的噪声影响,监测相对真实的趋势变化。
医疗器械上市后风险趋势分析方法的应用示例
历史数据确定控制限
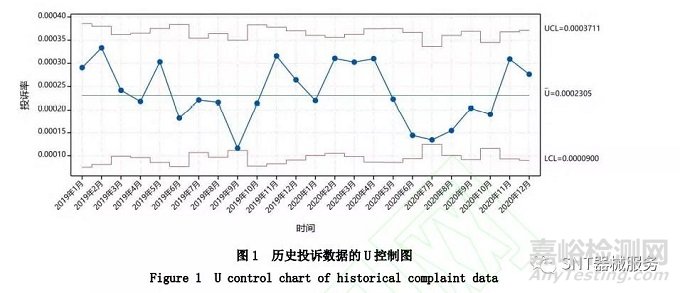
在初次建立趋势分析方法时,《控制图 第 2 部分:常规控制图》(GB/T 17989.2-2020)[5]中推荐的初始数据采集为 25 个子组,结合国内现状,考虑以24 个月度评估为基础确定控 制限。假设一个虚拟案例,某企业收集了某医疗器械产品 2019 年 1 月 1 日至 2020 年12 月31 日的包含不良事件在内的非严重投诉数据进行趋势分析,以 24 个月度的投诉率确定趋势分析的控制限;每个月的产品使用数量和投诉数量存在差异,24 个月累计产品使用量为2 763000,累计投诉数量为 637,平均投诉率约为 0.000 230 5;部分统计质量控制软件可用于控制图的数据分析和绘图,如Minitab 19 绘制的 U 控制图(图 1)。每个月的产品数量为变量,上下控制限动态变化,使用不相等样本量进行检验。图中 24 个月度评估周期的投诉率都在控制限的范围内,可作为对未来趋势持续监测的基础。
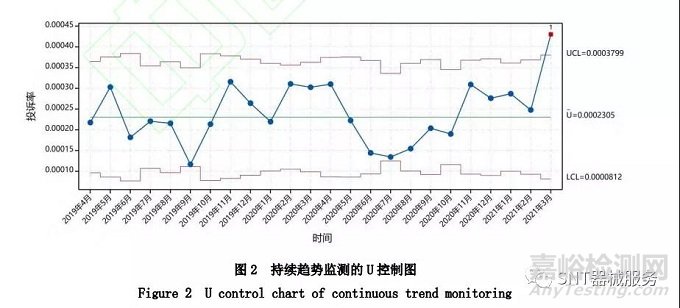
假设自2021年1月1日起,以过去2年历史数据计算得到的控制限为基础,对投诉率的趋势开展持续监测;依据图1将中心线设置为固定的U =0.000 230 5,持续监测2021年前3个月的投诉率,利用Minitab19绘制滚动显示24个月的U控制图(图2)。每个月的产品数量为变量,使用不相等样本量进行检验,在计算中使用估计的历史参数。2021年1月和2月的投诉率处于控制限的范围内,2021年3月的投诉率则超出了控制上限,图中显示了预警。
异常趋势处置
针对2021年3月的异常投诉数据,开展更深入分析,如生产数据回顾、设计开发回顾、分类投诉分析、异常故障分析、使用状况分析等,找出投诉率异常的根本原因。此外,需仔细评估异常投诉率背后的风险水平是否可接受,可结合风险矩阵[16-17]、失效模式[18]等方法评估相应的风险程度,然后决定采取何种具体的风险控制措施,并扭转投诉率的异常趋势。
推行趋势分析方法的必要性
当前医疗器械不良事件监测工作模式下,企业可收集到全面的大量上市后风险数据,给趋势分析方法的应用奠定了良好的数据基础,成为推广应用该方法的良机。2020 年 93.83 % 的不良事件是非严重事件[1],迫切需要引入合适的统计学手段,避免大量的精力耗费在个例的非严重报告上,避免遗漏潜在的风险。统计学方法的推行有助于提高生产企业的上市后风险管理水平,及时有效的控制产品风险。
趋势分析方法的应用场景
目前我国的法规尚未对趋势报告做出规定,但在不良事件监测工作的相关指南文件里提出了类似的要求,如《医疗器械定期风险评价报告撰写规范》[19]明确指出,应分析不良事件的报告频率是否增加、不良事件的特点和频率变化对产品总体安全性的影响。医疗器械风险管理体系中,要求收集生产和生产后信息并定期更新风险管理报告[16],也可应用趋势分析方法。此外,趋势分析作为日常风险管理的手段,通过监测异常趋势可有效实现预警,及时控制潜在风险。
趋势分析方法的适用性
建立科学的符合产品特点的方法学,才能有效的对风险进行评估和控制,并非每个产品在每个阶段都适用。当医疗器械产品上市后的销售、使用、反馈都相对稳定和成熟时,趋势分析方法可以得到更好的应用并实现预期的目的。在产品上市初期,需收集足够多的数据,进行反复的迭代计算,判断是否达到“受控”状态,以及何时可以开始对未来趋势的监测和控制。若企业的上市后投诉数据偏少,计算的投诉率变化无统计学意义或始终“不受控”, 则趋势分析方法不适用。
趋势分析方法的局限性
趋势分析只是风险管理的一部分,需与其他分析方法联用实现闭环。趋势分析从投诉发生率着手,反应的是产品风险的总体情况,判断是否处于受控状态,但并未识别风险的具体内容。当识别到异常趋势时,还需深入分析找出根本原因,结合风险矩阵、失效模式等评估方法,判断风险程度和采取何种风险控制措施。因此,企业需建立科学的风险管理体系,根据需要采用趋势分析、风险矩阵、失效模式等多种统计分析方法。
小结
随着我国不断加强对药品和医疗器械的监管,医疗器械生产企业的主体责任日益突出,给企业的风险管理水平提出了较高的要求。本研究参考欧盟新法规的要求,研究医疗器械上市后风险趋势的具体分析方法及应用,供企业借鉴,同时也为监管部门判断医疗器械产品风险提供参考。基于控制图的医疗器械上市后风险趋势分析方法虽早在十几年前已被提出,但国内运用极少,本研究详细介绍了这一方法的应用过程,以期更多企业可采用真实世界风险数据开展运用,建立适合产品特点的科学方法,切实起到风险监测、预警和控制的目的,不断提升医疗器械上市后风险管理水平。
参考文献
[1] National Medical Products Administration. Annual report of national medical device adverse event monitoring (2020)[EB/OL]. ( 2021-03-29 ) [2021-03-29]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjylqx/20210329170305102.html.
[2] The State Council. Regulations on the supervision and administration of medical devices(2021)[EB/OL]. (2021-03-18) [2021-03-29]. http://www.gov.cn/zhengce/content/2021-03/18/content_5593739.htm.
[3] European Union Law. EU. regulation (EU) 2017/745 of the european parliament and of the council[EB/OL]. (2017-05-05)[2021-03-29]. https://ec.europa.eu/health/md_sector/new_regulations_en.
[4] The Global Harmonization Task Force. Global guidance for adverse event reporting[EB/OL]. (2005-09-15) [2021-03-29]. http://www.imdrf.org/ghtf/ghtf-archives-sg2.asp.
[5] State Administration for Market Regulation, Standardization Administration. Control charts Part 2: Shewhart control charts(GB/T 17989.2-2020)(控制图 第 2 部分:常规控制图(GB/T 17989.2-2020))[S]. Beijing: State Administration for Market Regulation, Standardization Administration, 2020.
[6] Li JW, Lu YQ, Li JX. Application of SPC control chart in the development of small batch aerospace products [J]. Technology Innovation and Application(科技创新与应用), 2019 (2): 179-181.
[7] Liu ZS, Wang NK, Luo JP. Application of dynamic control chart in multi variety and small batch production [J]. Machinery Design & Manufacture(机械设计与制造), 2017 (5): 96-98.
[8] Xu HL. Application of P control chart in quality control of medical devices[J]. Chinese Journal of medical instrumentation(中国医疗器械杂志), 2005, 29 (4): 283-284.
[9] Liu HT. Application of EWMA control chart system in the management of medical device manufacturing[J]. China medical device information(中国医疗器械信息), 2010, 16 (12): 25, 36.
[10] Xiao Q, Li GJ, Zhang XB, et al. Application of statistical process control in evaluation of performance for beam-matched medical electron linacs[J]. Chinese Journal of medical instrumentation(中国医疗器械杂志), 2021, 45(1): 109-113. [11] Zhou HL, Feng WZ, Li HY, et al.Application of quality control chart in continuous improvement of medical quality[J]. Chinese Health Quality Management(中国卫生质量管理), 2015, 127(22): 30-32.
[12] Gao LH, Ma DH, Zhang L. Application of quality control chart in management of nursing adverse events[J]. Journal of Nursing Administration(护理管理杂志), 2020(12): 895-898.
[13] China Food and Drug Administration.YY/T 0287-2017 Medical device-Quality management systems-Requirements for regulatory purpose(YY/T 0287-2017 医疗器械 质量管理体系 用于法规的要求) [S].Beijing: China Food and Drug Administration, 2017.
[14] State Administration for Market Ragulation. Supervision order for adverse events monitoring and re-evaluation of medical devices. (2018-08-31)[2021-03-29]. http://gkml.samr.gov.cn/nsjg/bgt/202106/t20210624_331375.html
[15] State Administration for Market Regulation, Standardization Administration. Control charts - Part 6: EWMA control charts(ISO 7870-6:2016)(控制图-第 6 部分:指数加权移动平均值控制图(ISO 7870-6:2016) ) [S]. Beijing: State Administration for Market Regulation, Standardization Administration, 2016.
[16] China Food and Drug Administration.YY/T 0316-2016 Medical devices-Application of risk management to medical devices(YY/T 0316-2016 医疗器械 风险管理对医疗器械的应用) [S]. Beijing: China Food and Drug Administration, 2016.
[17] Li LH, Chen YF. Application of risk matrix in post-marketing drug risk assessment: a case study of Terfenadine[J].Chinese Journal of Pharmacovigilance(中国药物警戒),2013, 10(6): 358-361.
[18 ]Cheng YZ, Luo WX, Huang FF. Risk analysis of pacemaker system based on failure mode and effect analysis[J].Chinese Journal of Pharmacovigilance(中国药物警戒),2014, 11(2): 104-108. [19] National Medical Products Administration.Standard for writing periodic risk assessment report of medical devices(No.46, 2020)[EB/OL]. ( 2020-07-24 ) [2021-03-29]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20200702155401886.html.

来源:中国药物警戒


