您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-11-28 22:39
FDA批准RLD 新药上市,各国药典无收载,无进口注册标准。没有质量标准参考,怎么办。
思路:(1)根据原料药合成工艺,参考EMEA审评报告和FDA Rew等,确定各检测指标;(2)参考ICH Q3系列、RLD数据等建立限度;(3)分析方法开发。
建立质量标准各项检测指标
一、EMEA审评报告
Itappears as a white, amorphous, hygroscopic powder. It is very soluble in waterand over the pH range 1-7. It is also very soluble in methanol and sparinglysoluble in ethanol. Two pKa values have been found and calculated to be 2.0 and7.3. Its logPoct/wat calculated by software is 1.31.
原料药物理性质:白色粉末,易潮解。易溶于水,易溶于甲醇和乙醇。
The active substance specification includesappropriate tests and limits for: appearance (visual inspection), appearance ofsolution (Ph. Eur.), pH (Ph. Eur.), identity (IR, HPLC), enantiomer (HPLC),assay (HPLC), related substances (HPLC), genotoxic impurities (HPLC/MS, HPLC),sulfate anion (ion chromatography), residual solvents (GC), water content (Ph.Eur.), sulphated ash (Ph. Eur.), bacterial endotoxins (Ph. Eur.) andmicrobiological quality (Ph. Eur.)
原料药质量标准:性状、溶液的澄清度与颜色、pH、鉴别(IR、HPLC)、对映体、含量、有关物质、遗传毒性杂质(GTI-1,GTI-2)、硫酸根阴离子、残留溶剂、水分、硫酸灰分、细菌内毒素、微生物限度。
二、FDA Rew
Rew提供了COA,见下图(部分截图),FDA版的检测指标与EMEA一致。其中FDA Rew提供了其它信息:pH值和溶液的澄清度与颜色项下试品溶液浓度;有关物质有2个代号的杂质(代号可检索结构);2个遗传毒性杂质,一个有代号,另一个是提供了英文名称(可检索)。
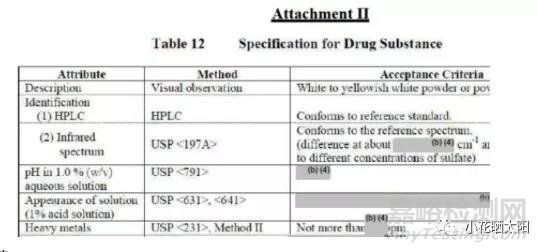
三、合成工艺
化试包括甲醇、乙醇、硫酸等。甲醇/乙醇与硫酸可产生硫酸二甲酯/硫酸二乙酯(遗传毒性杂质)。基于对API的理解增加氟检查;参考法规增加重金属。
四、质量标准小结
性状、溶解度、熔点、鉴别、pH、溶液的澄清度与颜色、氟检查、有关物质、对映体异构体、遗传毒性杂质(GTI-1,GTI-2)、硫酸二甲酯、硫酸二乙酯、硫酸根离子、残留溶剂、水分、炽灼残渣、重金属、细菌内毒素、微生物限度、含量。
五、各项检测指标的制订
1、性状:白色粉末,易潮解。参考EMEA报告
2、溶解度:易溶于水,易溶于甲醇和乙醇。参考EMEA报告
3、熔点:根据数据制订。
4、鉴别:IR、HPLC。参考EMEA报告
5、pH:4-7。根据数据制定,在文献1-7的范围内。
6、溶液的澄清度与颜色:澄清无色。原料药供注射用,RLD复溶为澄清无色。
7、氟检查:20%。根据分子式计算,API为阳离子-硫酸根为1:1(也存在1:2),用于判断盐型。
8、有关物质:未知杂质小于0.08%(ICH Q3A),已知杂质、总杂的限度使用RLD稳定性数据外推(JMP软件或阿伦尼乌斯公式)。
9、对映体异构体:小于0.5%。参考CDE《关于手性药物药学研究的几点看法》。
10、非对映异构体:小于0.5%。同9。
11、遗传毒性杂质(GTI-1):30ppm。EMEA报告为37ug/d,GTI-1在血液中半衰期小于2min,风险可忽略不计。
12、遗传毒性杂质(GTI-2):3.7ppm。TD50为4.2,为CPDB数据,按M7公式计算。
13、硫酸二甲酯、硫酸二乙酯:1.3ppm。按1.5ug/d计算。
14、残留溶剂:参考ICH Q3C。
15、硫酸根离子:不得过15%。参考RLD数据,工艺采用硫酸转盐,存在结合硫酸和游离硫酸。
16、水分:0.5%。根据数据制订,其中API对水分不稳定。
17、炽灼残渣:小于1.0%。残渣为钠离子,离子交换步骤引入氢氧化钠,根据数据制定。
18、重金属:小于10ppm。ICP-MS结果表明无重金属,重金属以铅计,本品每日摄入量<0.5g,治疗时间>30天,根据EMA指南制定。
19、细菌内毒素:0.26EU/mg。内毒素=K/M。K=5;M中体重按60kg计,注射不足1小时按1小时计(相当取最大值),单次最大剂量参考用法用量。
20、微生物限度:略。供注射剂用。
21、含量:按无水物无溶剂计算,不得少98.0%。为了获得准确含量,按干品计。
建立理化分析方法
1、性状、溶解度、熔点、鉴别、氟检查、水分、炽灼残渣、重金属、细菌内毒素、微生物限度:按药典通则方法。
2、pH值
a.溶剂为水
EMA指南:溶剂首选水。本品易溶于水,溶剂选择水,与COA信息一致。
b. 浓度为10mg/ml
EMA指南关于pH值的供试品浓度:一般的供试品溶液浓度为20~50g/L,但也可能较低浓度(比如10g/l)或较高浓度(100g/l或更高浓度的其他特殊情况)的供试品溶液。本品为前药,在水中的浓度超过20mg/ml可析出活性成分,考虑析出的影响,选择10mg/ml,该浓度与COA信息一致。
3、溶液的澄清度与颜色
a.溶剂为0.1%HCI水溶液
EMA指南:溶剂首选水。本品在水中降解产生 活性成分,活性成分微溶于水但溶于盐酸,0.1%盐酸的浓度可满足活性成分的溶解要求。溶剂选择0.1%HCI水溶液,与COA信息一致。
b.浓度为40mg/ml
EMA指南:供试品溶液通常在10mg/ml-50mg/ml之间。为了桥接原料药与成品(注射剂),由RLD说明书可知,每支约含API 400mg(过量灌装6%),稀释体积按5的整数倍选择10ml,供试品浓度为40mg/ml,在EMA指南的范围内。
4、小结
关于“pH值“和“溶液的澄清度与颜色”的供试品浓度,通常选择最大的浓度。

来源:Internet


