您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-06 23:50
前 言
生物样品的稳定性考察往往根据具体样品采集的情况,对生物样品在室温、冰冻或冻融、不同存放时间进行稳定性考察,同时还需注意储备液的稳定性以及样品处理后的溶液中分析物的稳定性,以最大程度保证样品测定结果的准确性和可靠性。
稳定性研究的意义
生物样品稳定性研究常常是所有分析研究人员日常热议的话题之一。如在国际生物分析论坛上其也是受到广大研究人员的青睐。表1所示是第二届国际生物分析论坛拟讨论主题投票结果。其中,前五项得票最高的有三项与生物样品稳定性直接相关,说明生物样品稳定性研究的重要性,因为保证样品在生物基质中的稳定性是生物样品分析的基本前提。
表1 第二届国际生物分析论坛讨论主题调查结果

基于此,各国药监部门均建议对实际研究样品进行再分析。主要是因为配制的校正标样和真实研究样品之间存在差别,这种差别是由于真实样品经历了体内循环及代谢转化途径。导致再分析失败的主要原因是分析物在基质中不稳定,及其样品中不稳定的代谢产物和生物样品中的相关基质组分。如图1所示,比较了文献报道案例中已测样品再分析(ISR)失败的各种原因所占的比例。
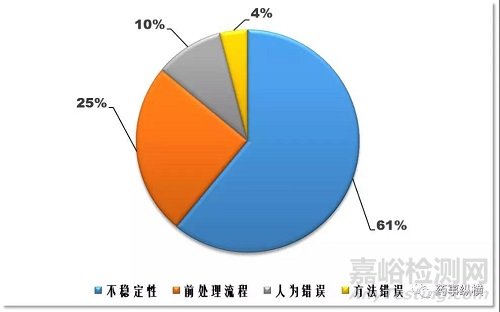
图1 文献报道的案例中ISR失败的各种原因
现在对ISR和已测样品稳定性(ISS)的研究已成为生物分析中不可缺少的一部分,是一种评估方法重现性的重要指标。ISR是通过选择部分样品进行重新分析,所测值与最初测试结果比对,从而证实方法的可信度。ISS是监测分析物和代谢产物在储存期间稳定性的方式,足见稳定性研究的重要性。
稳定性研究的主要内容
尽管FDA指导原则(2018年05月发布)中包含6个方面(自动进样器中稳定性、室温稳定性、样品处理后溶液稳定、冻融稳定性、长期稳定性和储备液或工作液稳定性),但从指导原则中我们可以理解样品稳定性包含了5个方面,并不是所有的稳定性项目我们必须考擦,在申报资料中常常只对其中的2~3项进行考察。中国药典(2015版)中提及稳定性检查应考察不同储存条件,时间尺度应不小于试验样品储存时间。通常应该进行分析物和内标的储备液和工作液的稳定性、从冰箱储存条件到室温或样品处理温度、基质中分析物的冷冻和融化稳定性以及基质中分析物在冰箱储存的长期稳定性考察。此外,如果适用,也应该进行处理过的样品在室温下和试验过程储存条件下的稳定性以及处理过的样品在自动进样器温度下的稳定性考察。
1、冰冻稳定性(冷冻稳定性或长期稳定性)
配制好数份低、中、高含药生物样品后冰冻,分别在数天或数十天时,取出化冻测定血药浓度,计算回收率来考察稳定性。冷冻稳定性(常规为-20°C)的目的是考察样品贮存的低温极限条件。因此所有样品分析必须满足一定时间内在特定的贮存温度下的稳定性要求。如有些样品冻存仅一周稳定,不能满足样品分析周期要求,可采用合适的方式延长冷冻稳定性,如采用超低温冰箱保存降低冰冻温度,也可采用加入适当的稳定剂,如含巯基化合物,添加抗氧化剂维生素C能大大延长冷冻稳定性。
2、样品处理后的溶液中分析物的稳定性(测定溶液的稳定性)
含药生物样品于配制好后按“血浆样品的处理”项立即处理,置室温中分别在数小时或数十小时时测定,常将测定溶液放置在低温进样器中考察。该实验的目的是考察在样品量大、分析批内待机时间长所致的待测样品发生的变化或仪器污染/疲劳/基线漂移等所造成的系统偏差。
HPLC法中如采用UV或FLD检测,可采用统计样品主峰面积RSD%考察。生物样本污染较大,当采用MS或MS/MS检测时,连续进样易污染加热毛细管,导致主峰面积逐渐下降,此时需要同时跟踪线性测定进行考察。也可考察降解杂质的变化来判断,如含奥美拉唑生物样品通过考察主要降解杂质磺酰化物,这种方法有时更为准确。
3、冻融稳定性
配制好低、中、高含药生物样品,冻融数次(常3次),测定血药浓度,计算回收率来考察稳定性。FDA指导原则中规定采用QC样品进行冻融稳定性考察,冻融次数至少为3次以上且每次样品冻存时间至少12 h以上,然后再进行后续循环步骤。
由于生物样品分析复杂、误差大,易产生可疑数据,往往需要重新测定来确定数据的可信度,该稳定性为上述测定提供保证。如含赖诺普利血样,冷冻放置7天内基本稳定,冻融两次赖诺普利降解50%以上。解决冻融不稳定性的办法有:血样采集分离后,立即定量分成多份冷冻方式,以满足实验要求。
4、室温稳定性
配制好低、中、高含药生物样品后,在室温条件下放置数小时至数十小时后,按“血浆样品的处理”项立即处理测定,计算回收率来考察稳定性。该实验目的考察血浆样品处理过程中,待处理样品放置的合适条件。如文献报道,含尼莫地平血样在室温稳定性较差,需要冻融后立即处理测定,但这种情况会影响测定的效率,经室温稳定性考察后发现,在严格避光条件下,血样在24 h内稳定。
5、储备液的稳定性
对照品储备液分别置冰箱中(4℃)放置数天数十天后,取出后直接测定,测定方法可不同于含药生物样品的测定。如仅放置几天,可采用测定条件连续测定,计算样品主峰面积的RSD%来考察;如对照品容易获得,可采用新配制对照品溶液外标法计算储备液的含量来考察;对于昂贵的对照品(如代谢物)可采用HPLC归一化法联合吸收系数法来考察待测成分的变化。
最后需要强调的是,由于样品千差万别,理化性质各有不同,为保证测定的准确性,还需要视化合物不同开展其他的稳定性考察,如光解效应、氧化效应、吸附效应。
稳定性的评估
1、全血稳定性评估目的
评估药物在全血中稳定性的科学理由是为了给动物或临床中心提供相关指导,以确保药物在整个采集过程中稳定。药物全血稳定性评估应该在要验证的方法所使用的种属基质中进行。但是在实验之前,建议查询现有的关于该目标药物全血稳定性文献,此外也可以参考该药物在生产控制开发阶段已经建立的化学稳定性及其它结构类似化合物包括已知杂质的稳定性。
实例:如表2所示,曲普瑞林在大鼠全血中稳定性考察结果显示曲普瑞林在大鼠全血中不稳定,室温条件下0.5 h已经有接近30%的曲普瑞林被降解或转化,湿冰上放置2 h后也不稳定。然而,有数据表明曲普瑞林在大鼠血浆中室温放置6 h是稳定的。对于睾酮而言,其在全血和血浆条件下均为稳定。
表2 曲普瑞林和睾酮在大鼠全血中稳定性结果
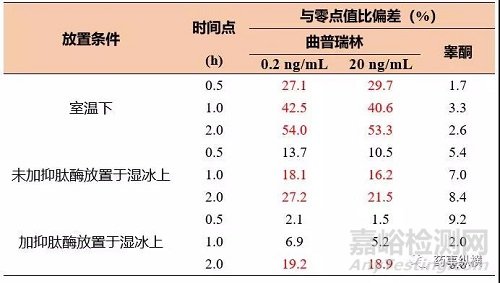
故稳定性考察应该能覆盖所有全血样品采集和血浆、血清样品产生的步骤。这包括如何从受试者或动物采集全血样品(如有必要)及冷冻储存和运输前的血浆、血清制备步骤。
2、影响药物全血稳定性的因素
一些环境和化学因素能影响药物在全血里的稳定性。常见的化学和环境方面的因素有:取样基质的天然pH或加入一些抗凝剂后改变pH影响药物的稳定性;光氧化影响药物的稳定性。另外,全血中含有的具清除氧气属性的血红蛋白有光氧化稳定化效果,故和血浆样品相比,全血更不容易有光氧化稳定性问题。
在某种程度上,这些化学和环境方面的因素比较容易控制。但是,生物因素会对药物在基质里的不稳定性有显著的影响。例如,存在于红细胞和血浆中的有些酶能影响到药物的稳定性。
3、从全血获得血浆的稳定性的评估方法
如果用血浆作为分析基质,用来做稳定性实验的含有分析物的全血样品需要被处理成血浆并用在后续的分析里。衍生血浆的方式依靠测定药物在血浆(时间零点)中的初始浓度,稳定性是比较它与后续测定得到的数值。在这种实验中,全血要在最开始就加入药物。在测定零点时间值前,分析物必须要在血液成分中平衡,因此药物在血浆中的标示浓度是未知的。虽然看起来与业界指导及规范阐述的一般的稳定性途径相违背,但这种做法还是被广泛接受,因为它保持了足够的科学性。
一般来说,稳定性评估会选择多个时间点(如0h,1h,2h,4h,6h)测量衍生的血浆样品。测试的样品会储存在室温条件下以代表采血中心的条件。时间零点的全血样品的血浆部分会在全血和血浆分离完成后得到,放置的全血的血浆会在预定时间制取。血浆样品会-20°C储存(如果冻融和冷冻稳定性已经建立),所有样品会在一个分析批里完成用以防止批间差异,并且和校正标样、6个QC样品一起分析。每个时间点与零时间点测定的药物浓度作比较,接受标准是常规的±15%。另外的选择是简单地比较每个时间点与零时间点测定的检测器响应值(峰面积或使用内标时为峰面积比),接受标准是±15%,这种做法的优点是不用使用校正曲线。
该方法评估全血稳定性的主要确定是这种方法主要依赖零时间点样品。因为当药物加入到全血样品中后,药物分配到全血,不同组分达到平衡的时间是未知的。一般这个现象的动力学一般是很快的,但是有文献报道某些化合物达到分配平衡需要很长时间。故零时间点也只能是随机设定。达到分配平衡前设定的零时间点可能会导致失败和短的稳定性周期。
4、全血的稳定性的评估方法
如果选择全血作为分析基质进行稳定性考察,上面提及的平衡分配的现象就不是一个主要的问题。用全血基质的常规实验设计被认为是黄金标准方案,但这会导致问题复杂,因为血浆或血清的方法可能不适于分析全血样品。
在这种情况下,可以使用简单的不包括在方法验证程序里的但专为全血稳定性评估使用的蛋白沉淀方法。用这种方式,全血稳定性样品可以通过延用一个认证的方法并结合在全血中准备的校正标样和QC样品进行评估,并用常规的接受标准来定量。但是,直接简单地比较零时间点和在指定存放周期后的样品响应值偏差范围可能会更直接。如果响应值偏差在±15%内,稳定性就可以确定。
此外,采用真实样品来做全血稳定性评估。这种方式不需要假设加入分析物的全血样品,类同于从受试者采到全血样品,也不需要知道平衡时间。实际上,这是最好的用于测定试验样品稳定性的方法,但因为药物在全血中的初始浓度是未知的,可能不会被法规部门接受。
5、稳定性研究一般评估方法及统计方法
中国药典(2015版)中规定:采用低和高浓度质控样品(空白基质加入分析物至定量下限3倍以内以及接近定量上限),在预处理后以及在所评价的条件储存后立即分析。由新鲜配制的校正标样获得标准曲线,根据标准曲线分析质控样品,将测得浓度与指示浓度相比较,每一浓度的均值与表示浓度的偏差应在±15%范围内,但未明确指出平行样品个数。不过,在生物分析稳定性评估的接受标准是熟悉的4-6-15规则。也就是说,在一系列的6个重复稳定性样品中至少4个样品的结果必须落在理论值或零时间点值的15%内。
稳定性影响因素及控制策略
1、物理因素
(1)光敏性
光化学不稳定性药物常见于含有不饱和碳碳双键分子(如可能会发生E/Z异构化的链烯烃)和(或)含有杂环双键,如羰基、硝基芳香族基团和芳基氯化物基团(其中可能发生脱氯反应)的分子。
对于光敏感的样品,在样品采集时可采用棕色样品采集管,或者在采集管外包裹锡箔,在只能透过特定波长(如滤过黄色光)的灯光下进行操作,以及将样品储存在避光箱内。如果化合物对光及其敏感,可以使用光度计测定保持样品稳定的最大光强度。
例如,洛美沙星光化学降解反应产生两个主要的降解产物。
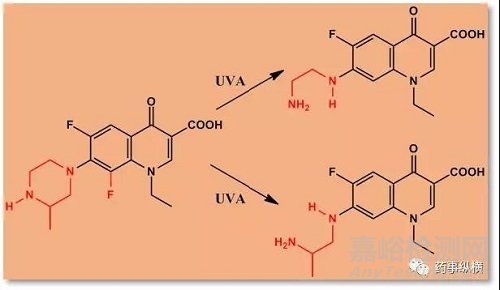
(2)热不稳定
升高温度会加速化合物在指定基质中的降解速率或者导致一些不良的化学反应。对于此类药物,最好的办法是将全血样品采集后立即冷冻保存(如果生物基质是全血),或立即将全血样品进行处理,如在4°C及以下温度离心获得血浆样品后迅速放入-80°C冰箱保存。
(3)酸碱度不稳定
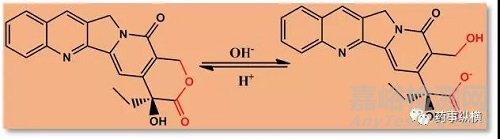
由于某些化学反应需要在特定的pH条件下才能被催化,某些酶只能在特定的pH范围内才能起作用,因此对于对化学及酶不稳定的化合物,控制pH非常重要。典型的受pH影响的不稳定化合物包括易形成酰基葡萄糖醛酸的代谢产物、酯类、酰胺类、内酯类、内酰胺类的酸性化合物。比如他汀类药物转化(内酯环水解)为β羟基他汀酸。在较高pH环境如生理pH下,这种转化会增强,严格控制pH在4.5,并且在低温环境下能减少这种转化。
例如,喜树碱在不同pH条件下其内酯和羧酸盐形式之间的互相转变。
(4)酶催化导致不稳定
在确定样品不稳定是由于酶的作用前,首先应该排除不稳定不是因为化合物水解造成的,否者即使添加酶抑制剂也不能起到稳定化合物的作用。并在选择酶抑制剂时应优选考虑低毒性的物质。
通常会在样品采集管里添加氟化钠用来测定葡萄糖含量,它能够抑制葡萄糖代谢,并且是一种蛋白质变性剂。另一种阻止因为酶作用使化合物不稳定的方法是直接将样品采集到有机溶剂中,因为有机溶剂能使蛋白质和酶变性。
酯酶是导致化合物不稳定的最普遍的酶。酯酶又可以分为胆碱酯酶、羧酸酯酶、丝氨酸酯酶和芳基酯酶。这些酶在全血、血浆、血清及生物组织(如肝脏)等生物基质里有不同的含量。这些酶在啮齿类动物中大量存在,但是在人体中含量较少。人血中只含有丁酰胆碱酯酶、乙酰胆碱酯酶、白蛋白酯酶和对氧磷酶这四种酯酶。表3列举了一些全血和血浆中常见酶的种类及它们的酶抑制剂和需要添加这些酶抑制剂的化合物。另外值得注意的是,所有用到的空白基质都应该加入与样品中添加量相等的酶抑制剂。
表3 常见酶的类别及对应的酶抑制剂举例

(5)化学因素
1)由于氧化原因导致的不稳定
这种不稳定通常存在于含有苯基或羟基的化合物中。最常用的抗氧化剂是维生素C,另一种广泛用来稳定亲脂性化合物如维生素A、维生素E的抗氧化剂是BHT,该抗氧化及的浓度依据稀释剂的种类有所不同。
例如,硝苯地平光化学降解后的氧化反应。
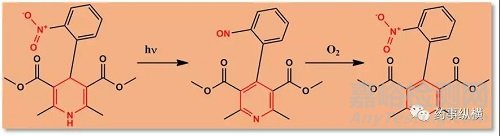
另一类容易被氧化的化合物是硫醇类化合物。硫醇类化合物可形成二聚体,或在分子内形成二硫键,如半胱氨酸等含硫基团的化合物。为了稳定这类分子,可以选择在样品采集时将其衍生化。甲基丙烯酸酯是一个好的衍生化试剂,且经其衍生化后的化合物并不产生新的手性中心。
2)N-氧化物相互转化
N-氧化物是众所周知的在生物样品中不稳定的一类代谢产物。这类化合物通常在还未从全血中制备成血浆时就已经不稳定了。同时,在样品中加入某些稳定原药的试剂(如维生素C)也有可能导致N-氧化物发生还原反应。因此,在分析此类化合物时,无论在样品采集阶段还是样品分析处理阶段都应该十分小心。
3)手性化合物相互转化
所有的手性化合物在特定的条件下都会相互转化,但是通常只有在生理pH或正常生物体温下的转化才会对生物分析造成一定的影响。一般情况下,可以选择加入缓冲试剂改变其pH,或将样品储存在-80°C下。
小分子化合物在生物基质中稳定性控制策略及示例
1、稳定性控制策略
如图2所示,为小分子化合物在生物基质中稳定性控制策略流程图,基于待分析化合物结构特点并按照该流程思路进行排查,能便于解决基质中不稳定化合物问题。值得指出的是,稳定性研究也遵循case by case的原则,也就是根据生物活性物质结构特点及基质类型等对稳定性的影响。
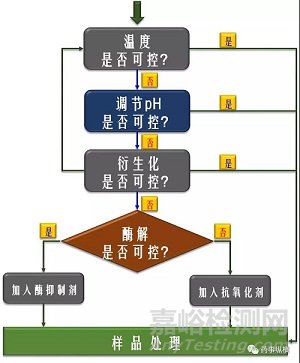
图2 小分子化合物在生物基质中稳定性控制策略流程图
2、稳定性控制举例
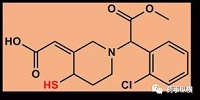
(1)氯吡格雷代谢物

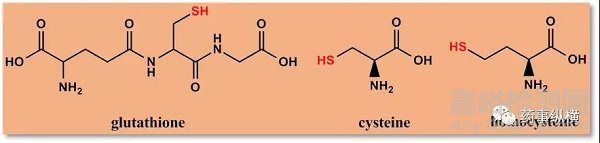
(2)谷胱甘肽、半胱氨酸和同型半胱氨酸

(3)霉酚酸酰基葡糖苷酸
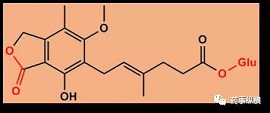

(4)咖啡酸类及其氟化衍生物
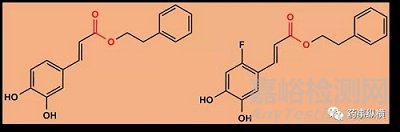

(5)辛伐他汀及辛伐他汀酸
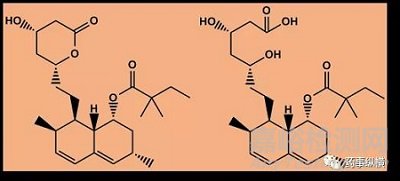

(6)萘莫司他
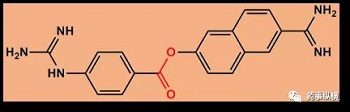

(7)吉西他滨

小结
综上所述,不难判断出生物样品稳定性对于保证样品分析结果准确性和重现性具有的重要意义,同时其也是生物分析方法学验证中关键的环节,需要我们较为细致的研究。可逆和不可逆反应都能在生物基质分析中遇到并能影响原型药物和药物代谢产物的稳定性。温度、光照、pH、氧化和酶解反应是样品在基质中稳定性最为常见的影响因素。除此之外,手性化合物和氘代内标可能会因其它影响因素而发生降解,故在进行稳定性研究过程中也要予以考虑。最后,本文限于笔者水平,如有不足之处,请大家多多指教,望能趁此机会和大家一起交流和学习。
参考文献
[1]CDE, 郑国钢, 生物样本分析样品稳定性考察的技术要求分析, 2007年06月20日.
[2] CDE, 白玉, 对生物制剂稳定性研究有关问题的思考, 2005年08月25日.
[3] Global CRO Council,Recommendations on: internal standard criteria, stability, incurred samplereanalysis and recent 483s by the Global CRO Council for Bioanalysis [J], Bioanalysis,2011, 3(12), 1323–1332.
[4] 李文魁等译, 液相色谱-质谱(LC-MS)生物分析手册: 最佳实践、实验方案及相关法规[M], 科学出版社 (2017年).
[5] Han J, Zhang S, Liu W, etal. An analytical strategy to characterize the pharmacokinetics andpharmacodynamics of triptorelin in rats based on simultaneous LC–MS/MS analysisof triptorelin and endogenous testosterone in rat plasma[J]. Analytical &Bioanalytical Chemistry, 2014, 406(9-10):2457-2465.
[6] Li W, Zhang J, Tse F L S.Strategies in quantitative LC-MS/MS analysis of unstable small molecules inbiological matrices[J]. Biomedical Chromatography, 2011, 25(1-2):258-277.
[7] Chen J, Hsieh Y.Stabilizing drug molecules in biological samples.[J]. Therapeutic DrugMonitoring, 2005, 27(5):617.
[8] Briscoe C J, Hage D S.Factors affecting the stability of drugs and drug metabolites in biologicalmatrices.[J]. Bioanalysis, 2009, 1(1):205-220.
[9] 中国药典2015版, 生物样品定量分析方法验证指导原则 (9012)
[10] CDER-FDA, Bioanalytical method validationguidance for industry, May 2018

来源:Internet


